Etano para niños
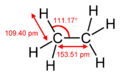
El etano es un tipo de hidrocarburo alifático que pertenece a la familia de los alcanos. Está formado por dos átomos de carbono y seis de hidrógeno, y su fórmula es C2H6. A temperatura y presión normales, el etano es un gas que no tiene color ni olor, y es un excelente combustible. Su punto de ebullición es de -88 °C.
El etano se encuentra en grandes cantidades en el gas natural. Al igual que otros hidrocarburos, se obtiene a gran escala de dos maneras: directamente del gas natural y como un producto secundario del refino de petróleo. Su uso principal es como materia prima para fabricar etileno, que es otro compuesto químico muy importante.
Si se cambia uno de los átomos de hidrógeno del etano por otro grupo químico, se forman compuestos relacionados. Por ejemplo, si se le añade un grupo hidroxilo, se obtiene etanol, que es el tipo de alcohol que se encuentra en las bebidas.
Datos para niños
Etano |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Etano | ||
| General | ||
| Fórmula semidesarrollada | CH3–CH3 | |
| Fórmula estructural |  |
|
| Fórmula molecular | C2H6 | |
| Identificadores | ||
| Número CAS | 74-84-0 | |
| Número RTECS | KH3800000 | |
| ChEBI | 42266 | |
| ChEMBL | CHEMBL135626 | |
| ChemSpider | 6084 | |
| PubChem | 6324 | |
| UNII | L99N5N533T | |
|
InChI
InChI=InChI=1S/C2H6/c1-2/h1-2H3
Key: OTMSDBZUPAUEDD-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Densidad | 1,282 kg/m³; 0,001282 g/cm³ | |
| Masa molar | 30,07 g/mol | |
| Punto de fusión | 90,34 K (−183 °C) | |
| Punto de ebullición | 184,5 K (−89 °C) | |
| Temperatura crítica | 305 K (32 °C) | |
| Presión crítica | 49 atm | |
| Viscosidad | 0.877 cP | |
| Índice de refracción (nD) | 1.00076 (0 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 4,7 mL/100 mL agua | |
| Termoquímica | ||
| ΔfH0gas | -83,8 kJ/mol | |
| S0líquido, 1 bar | 126,7 J·mol–1·K–1 | |
| Peligrosidad | ||
| Punto de inflamabilidad | 138 K (−135 °C) | |
| NFPA 704 |
4
1
0
|
|
| Temperatura de autoignición | 745 K (472 °C) | |
| Límites de explosividad | 3 - 12.5% | |
| Riesgos | ||
| Ingestión | Náusea, vómitos, problemas estomacales. | |
| Inhalación | Incremento en la frecuencia cardíaca y de respiración. Dolores de cabeza, cambios de ánimo, confusión. Peligro, riesgo de paro cardíaco en casos graves. | |
| Piel | Daño debido a la exposición del líquido criogénico. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
Contenido
¿Cómo se descubrió el etano?
El etano fue creado por primera vez en 1834 por el científico Michael Faraday. Él usó un proceso llamado electrólisis en una solución de acetato de potasio. Al principio, Faraday pensó que el gas que había producido era metano y no siguió investigándolo.
Más tarde, entre 1847 y 1849, otros científicos como Hermann Kolbe y Edward Frankland también produjeron etano. Lo hicieron de diferentes maneras, incluyendo la electrólisis. Ellos también se equivocaron al identificarlo, pensando que era otra sustancia.
Fue en 1864 cuando Carl Schorlemmer corrigió este error. Él demostró que el producto de todas estas reacciones era, en realidad, etano. Ese mismo año, Edmund Ronalds también encontró etano disuelto en el petróleo crudo ligero de Pensilvania.
¿Qué propiedades tiene el etano?
A temperatura y presión normales, el etano es un gas que no tiene color ni olor. Su punto de ebullición es de -88.5 °C y su punto de fusión es de -182.8 °C. El etano sólido puede existir en diferentes formas. Cuando se enfría, primero se forma un cristal plástico donde las moléculas pueden girar libremente. Si se enfría aún más, se convierte en otra forma de etano. El etano se disuelve muy poco en agua.
¿Dónde encontramos etano en la naturaleza?
El etano se encuentra en pequeñas cantidades en la atmósfera terrestre. Actualmente, hay alrededor de 0.5 partes por billón (ppb) de etano en el aire a nivel del mar. Antes de la era industrial, esta concentración era menor. Gran parte del etano actual en la atmósfera proviene de la quema de combustible fósil.
Aunque el etano es un gas de efecto invernadero, es mucho menos abundante que el metano. Además, permanece en la atmósfera por menos tiempo y no absorbe tanto calor. Su efecto en el calentamiento global se debe principalmente a que se convierte en metano en la atmósfera.
El etano también se ha detectado en las atmósferas de los cuatro planetas gigantes (Júpiter, Saturno, Urano y Neptuno) y en Titán, una de las lunas de Saturno.
Etano en el espacio

El etano en las atmósferas de estos cuerpos celestes se forma por la acción de la luz solar sobre el gas metano. Los rayos ultravioleta del Sol pueden romper las moléculas de metano, y cuando dos partes de metano rotas se unen, forman etano.
En la atmósfera de la Tierra, otras sustancias transforman el etano en vapor de metanol en unos tres meses.
Se cree que el etano producido en Titán cae como "lluvia" sobre la superficie de la luna. Con el tiempo, este etano se ha acumulado en grandes "mares" de hidrocarburos que cubren gran parte de las regiones polares de Titán. En 2007, la sonda Cassini encontró un lago en el polo sur de Titán, llamado Ontario Lacus, que es similar al lago Ontario en la Tierra. Más tarde, se confirmó la presencia de etano líquido en este lago. También se descubrieron lagos mucho más grandes, como Ligeia Mare y Kraken Mare, cerca del polo norte de Titán. Se piensa que estos lagos están hechos principalmente de una mezcla de etano y metano líquidos.
En 1996, se encontró etano en el Cometa Hyakutake y en otros cometas después. La presencia de etano en estos cuerpos lejanos sugiere que el etano pudo haber sido un componente importante de la nebulosa solar original, de la cual se formaron el Sol y los planetas.
En 2006, científicos de la NASA anunciaron que habían detectado etano en la superficie de Plutón.
¿Para qué se usa el etano?
El uso principal del etano es para producir etileno mediante un proceso llamado craqueo al vapor. En este proceso, el etano se mezcla con vapor y se calienta a temperaturas muy altas (900 °C o más). Esto hace que el etano se rompa y se convierta en etileno. El etano es ideal para esto porque produce principalmente etileno, mientras que otros hidrocarburos más pesados generan una mezcla de diferentes productos.
También se está investigando el etano para crear otros productos químicos básicos. Por ejemplo, se busca una forma más económica de obtener cloruro de vinilo a partir del etano. Aunque se han desarrollado muchos métodos, las condiciones de reacción son difíciles. Actualmente, una empresa en Alemania tiene una planta piloto que convierte etano en cloruro de vinilo.
Otra empresa en Arabia Saudí está construyendo una planta para producir ácido acético a partir de la oxidación del etano. La viabilidad de este proceso depende del bajo costo del etano en esa región.
El etano también se puede usar como refrigerante en sistemas de enfriamiento muy potentes, llamados criogénicos. A una escala más pequeña, en la investigación científica, el etano líquido se usa para congelar rápidamente muestras con mucha agua para la criomicroscopía electrónica. Esto evita que se formen cristales de hielo que podrían dañar las muestras.
¿Es seguro el etano?
A temperatura ambiente, el etano es un gas extremadamente inflamable. Si se mezcla con el aire en ciertas proporciones (entre 3.0% y 12.5% de su volumen), puede formar una mezcla explosiva. Por eso, si hay escapes de etano, es muy importante seguir los procedimientos de seguridad para fugas de gas.
Cuando el etano se almacena como un líquido muy frío (criogénico), se necesitan precauciones adicionales. El contacto directo con el etano líquido puede causar congelaciones graves en la piel. Los vapores del etano líquido son más pesados que el aire y pueden acumularse en lugares bajos. Si estos vapores encuentran una fuente de ignición, pueden encenderse y el fuego podría extenderse hasta la fuente del etano.
El etano puede reducir la cantidad de oxígeno en el aire, lo que puede causar asfixia. Sin embargo, el etano no se considera tóxico y no se sabe que cause cáncer.
Véase también
 En inglés: Ethane Facts for Kids
En inglés: Ethane Facts for Kids
Galería de imágenes