Dióxido de azufre para niños
Datos para niños
Dióxido de azufre |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Dióxido de azufre | ||
| General | ||
| Otros nombres | Óxido de azufre (IV) Anhídrido sulfuroso Anhidruro del ácido sulfuroso |
|
| Fórmula estructural | 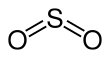 |
|
| Fórmula molecular | SO2 | |
| Identificadores | ||
| Número CAS | 7446-09-5 | |
| Número RTECS | WS4550000 | |
| ChEBI | 18422 | |
| ChEMBL | CHEMBL1235997 | |
| ChemSpider | 1087 | |
| DrugBank | DB16426 | |
| PubChem | 1119 | |
| UNII | 0UZA3422Q4 | |
| KEGG | D05961 | |
|
InChI
InChI=InChI=1S/O2S/c1-3-2
Key: RAHZWNYVWXNFOC-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 2,6288 kg/m³; 0,0026 g/cm³ | |
| Masa molar | 64,0638 g/mol | |
| Punto de fusión | 198 K (−75 °C) | |
| Punto de ebullición | 263 K (−10 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 9,4 g en 100 g de agua | |
| Momento dipolar | 1,63305 D | |
| Termoquímica | ||
| ΔfH0gas | –296,84 kJ/mol | |
| S0gas, 1 bar | 248,21 J·mol–1·K | |
| Peligrosidad | ||
| SGA |    |
|
| NFPA 704 |
0
3
0
|
|
| Frases R | R23 R34 | |
| Frases S | S1/2 S9 S26 S36/37/39 S45 | |
| Riesgos | ||
| Ingestión | Relativamente poco tóxico, puede causar náuseas, vómitos. Sin datos para exposición a largo plazo. | |
| Inhalación | Irritación extrema. | |
| Piel | Riesgoso comprimido y criogénico. | |
| Ojos | Riesgoso comprimido y criogénico. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El dióxido de azufre es un óxido con la fórmula molecular SO2. Es un gas que no tiene color y posee un olor fuerte y particular que puede ser irritante. Esta sustancia es un agente reductor. Con el tiempo, al entrar en contacto con el aire y la humedad, se transforma en trióxido de azufre, aunque esta reacción es lenta en condiciones normales.
Cuando el dióxido de azufre se disuelve en agua, forma una solución ácida. Se le puede considerar como el anhidruro de un ácido sulfuroso hipotético (H2SO3). Aunque este ácido es inestable en soluciones ácidas, puede formar sales llamadas sulfitos e hidrogenosulfitos.
Contenido
¿Cómo se produce el dióxido de azufre?
El dióxido de azufre se forma de varias maneras, tanto en la naturaleza como en procesos industriales.
Producción por combustión
Este gas se genera cuando el azufre y el sulfuro de hidrógeno se queman. Por ejemplo, la combustión del azufre puro produce dióxido de azufre:
- S8 + 8 O2 → 8 SO2
También se forma cuando el sulfuro de hidrógeno reacciona con el oxígeno:
- 2 H2S + 3 O2 → 2 H2O + 2 SO2
Obtención a partir de minerales
El dióxido de azufre también se puede obtener al calentar ciertos minerales sulfurados en un proceso llamado tostado. Algunos de estos minerales son la pirita (FeS), la blenda (ZnS), la galena (PbS) y el cinabrio (HgS).
Por ejemplo, al tostar pirita:
- 4 FeS + 7 O2 → 2Fe2O3 + 4 SO2
Y al tostar blenda:
- 2 ZnS + 3 O2 → 2 ZnO + 2 SO2
También se produce al calentar sulfato de cobre (II) pentahidratado (CuSO4•5H2O) a altas temperaturas. Primero se libera agua y luego se forma dióxido de azufre:
- CuSO4•5H2O → CuSO4 + 5 H2O (a 250 °C)
- 2 CuSO4 → 2CuO + 2 SO2 + O2
Reacción con ácido sulfúrico
Otra forma de producirlo es haciendo reaccionar cobre con ácido sulfúrico:
- Cu (s) + 2 H2SO4 (aq) → CuSO4 (aq) + SO2 (g) + 2 H2O (l)
¿Qué reacciones químicas tiene el dióxido de azufre?
El dióxido de azufre participa en varias reacciones químicas importantes.
Oxidación a trióxido de azufre
El dióxido de azufre puede oxidarse para formar trióxido de azufre. Esta reacción es muy lenta por sí sola, pero se acelera con la ayuda de sustancias llamadas catalizadores, como el pentóxido de vanadio (V2O5) o el platino. Esta oxidación es clave en la fabricación industrial de ácido sulfúrico.
Esta oxidación también ocurre en las capas altas de la atmósfera cuando el dióxido de azufre reacciona con el ozono. El trióxido de azufre resultante se combina con el agua de las nubes para formar ácido sulfúrico, lo que contribuye a la lluvia ácida.
- 3 SO2 + O3 → 3 SO3
- SO3 + H2O → H2SO4
Reacción con hidróxido de sodio
Cuando el dióxido de azufre reacciona con hidróxido de sodio, se produce sulfito de sodio y agua:
- SO2 + 2 NaOH → Na2SO3 + H2O
Reducción a azufre elemental
El dióxido de azufre también puede ser reducido por otras sustancias, como el ácido sulfhídrico. En esta reacción, se forma azufre puro y agua:
- SO2 (g) + 2 H2S (g) → 3 S + 2 H2O
¿Para qué se utiliza el dióxido de azufre?
El dióxido de azufre tiene muchos usos en diferentes industrias.
Como desinfectante y conservante
Históricamente, se ha usado como desinfectante. Por ejemplo, se quemaba azufre dentro de las cubas de vino para desinfectarlas. Hoy en día, se utiliza en la industria alimentaria como conservante y antioxidante (conocido como E220). Lo puedes encontrar en zumos, frutos secos, mermeladas y vino, ayudando a que duren más tiempo.
En la industria química
Es un paso intermedio muy importante en la fabricación de ácido sulfúrico. Al reaccionar con cloro, produce cloruro de sulfurilo (SO2Cl2), que es un compuesto esencial en la industria química. También se usa para crear detergentes y otras sustancias.
Otros usos importantes
En estado líquido, el dióxido de azufre es un buen disolvente. Además, se emplea en la potabilización del agua para ayudar a eliminar metales pesados como el cromo, el mercurio y el plomo.
¿Cómo afecta el dióxido de azufre al medio ambiente?
El dióxido de azufre es una de las principales causas de la lluvia ácida. En la atmósfera, se transforma en ácido sulfúrico, que luego cae con la lluvia.
Fuentes de emisión
Se libera en muchos procesos de combustión, ya que combustibles como el carbón, el petróleo, el diésel y el gas natural contienen compuestos de azufre. Por eso, se busca eliminar estos compuestos antes de quemarlos, por ejemplo, mediante la hidrodesulfuración en los derivados del petróleo.
Los procesos metalúrgicos también liberan este gas, porque a menudo se extraen metales de minerales que contienen azufre. En la naturaleza, el dióxido de azufre se encuentra cerca de los volcanes, y las erupciones pueden liberar grandes cantidades.
Control de emisiones
Para reducir la cantidad de dióxido de azufre en el aire, se pueden usar lavados especiales, por ejemplo, con leche de cal, para capturarlo de los gases de escape. También se puede transformar en azufre puro junto con sulfhídrico mediante el proceso de Claus.
¿Qué efectos tiene el dióxido de azufre en la salud?
El dióxido de azufre es un gas que puede ser irritante y dañino.
Efectos en el cuerpo
Afecta principalmente a las mucosidades y los pulmones, causando tos. Aunque el sistema nasal absorbe la mayor parte, respirar altas concentraciones por poco tiempo puede irritar las vías respiratorias, provocar bronquitis y dificultar la respiración en personas con asma.
Niveles de exposición
La cantidad máxima permitida de dióxido de azufre en los lugares de trabajo es de 2 ppm.
- El umbral de olor, es decir, la concentración más baja que el olfato humano puede detectar, es de 0,5 ppm (1 mg/m³).
Véase también
 En inglés: Sulfur dioxide Facts for Kids
En inglés: Sulfur dioxide Facts for Kids


