Óxido de azufre(VI) para niños
El óxido de azufre(VI), también conocido como trióxido de azufre (SO3), es una sustancia química que puede ser un sólido sin color con una textura fibrosa en condiciones normales. Sin embargo, a temperaturas más cálidas (como 25 °C) y presión normal, se convierte en un gas. Este gas es un contaminante importante en el aire y es la causa principal de la lluvia ácida.
El óxido de azufre(VI) se forma cuando el óxido de azufre(IV) reacciona con oxígeno en presencia de sustancias que aceleran la reacción, llamadas catalizadores, como el pentóxido de vanadio o el platino. Se produce en grandes cantidades porque es un paso clave para fabricar ácido sulfúrico.
Las principales fuentes de óxido de azufre(VI) que provienen de actividades humanas son la quema de combustibles fósiles, como el carbón y el petróleo. Respirar este gas puede causar irritación severa, náuseas, mareos y vómitos.
Datos para niños
Óxido de azufre(VI) |
||
|---|---|---|
| General | ||
| Fórmula estructural | 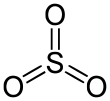 |
|
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7446-11-9 | |
| Número RTECS | WT4830000 | |
| ChEBI | 29384 | |
| ChemSpider | 23080 | |
| PubChem | 24682 | |
| UNII | HH2O7V4LYD | |
|
InChI
InChI=InChI=1S/O3S/c1-4(2)3
Key: AKEJUJNQAAGONA-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Masa molar | 79,957 g/mol | |
Contenido
¿Cómo es la estructura del óxido de azufre(VI)?
Cuando el óxido de azufre(VI) está en estado gaseoso, sus moléculas tienen una forma plana con tres lados, como un triángulo. En esta molécula, el átomo de azufre está en el centro y se une a tres átomos de oxígeno. El azufre tiene un estado de oxidación de +6, lo que significa que comparte sus electrones de una manera particular con los átomos de oxígeno.
¿Qué reacciones químicas importantes tiene?
El óxido de azufre(VI) reacciona muy rápido y con mucha fuerza cuando entra en contacto con el agua. Esta reacción produce ácido sulfúrico, que es una sustancia muy corrosiva. Por eso, el óxido de azufre(VI) es conocido como el "anhídrido ácido" del ácido sulfúrico. La reacción se ve así:
- SO3(l) + H2O(l) → H2SO4(l)
Esta reacción libera mucho calor, lo que la hace una reacción exotérmica. A una temperatura de unos 340 °C, el ácido sulfúrico, el óxido de azufre(VI) y el agua pueden existir juntos en equilibrio.
¿Cómo se produce el óxido de azufre(VI)?
El óxido de azufre(VI) se puede preparar en un laboratorio usando un proceso de dos pasos llamado pirólisis a partir de hidrogenosulfato de sodio. Primero, se deshidrata el hidrogenosulfato de sodio a 315 °C, y luego se "rompe" el compuesto resultante a 460 °C para obtener el óxido de azufre(VI).
A nivel industrial, la mayor parte del óxido de azufre(VI) se produce mediante un método llamado proceso de contacto. En este proceso, el óxido de azufre(IV) (que se obtiene quemando azufre o pirita) se purifica. Luego, este gas purificado se mezcla con oxígeno y se calienta a una temperatura de entre 400 y 600 °C. Para que la reacción ocurra de manera eficiente, se usa un catalizador de pentóxido de vanadio con óxido de potasio. Aunque el platino también es un buen catalizador, es muy caro y se contamina fácilmente.
La mayor parte del óxido de azufre(VI) que se produce industrialmente se convierte en ácido sulfúrico. Sin embargo, no se le añade agua directamente, ya que esto crearía vapores peligrosos. En su lugar, se absorbe en ácido sulfúrico concentrado para formar una sustancia llamada oleum, que luego se diluye con agua para obtener el ácido sulfúrico final.
¿Cómo es el óxido de azufre(VI) en estado sólido?
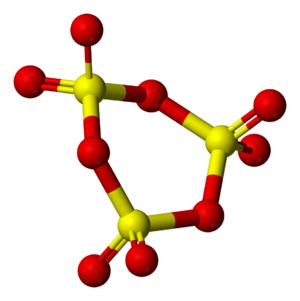
La forma sólida del óxido de azufre(VI) es bastante compleja y puede cambiar dependiendo de la cantidad de agua que haya en el ambiente. Cuando el gas de óxido de azufre(VI) puro se enfría, se convierte en un sólido llamado γ-SO3. Esta forma es incolora, se derrite a 16.8 °C y tiene una estructura molecular en forma de anillo.
Si el óxido de azufre(VI) se enfría a unos 27 °C, se forma otra versión sólida llamada α-SO3. Esta tiene una apariencia fibrosa. También existe una forma β-SO3, que es fibrosa pero tiene un peso molecular diferente y se derrite a 32.5 °C. Las formas gamma y beta no son tan estables como la alfa y, con el tiempo, se transforman en la forma alfa, especialmente si hay pequeñas cantidades de agua.
El óxido de azufre(VI) es muy higroscópico, lo que significa que absorbe la humedad del aire con mucha facilidad. De hecho, cuando el óxido de azufre(VI) entra en contacto con materiales como la madera o el algodón, puede quitarles el agua tan rápidamente que el calor generado puede hacer que estos materiales se quemen.
Véase también
 En inglés: Sulfur trioxide Facts for Kids
En inglés: Sulfur trioxide Facts for Kids