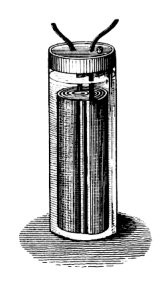
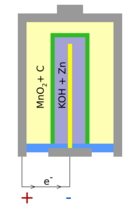
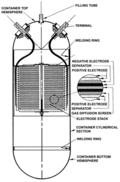
Historia de la pila para niños
La historia de la pila nos cuenta cómo se han creado y mejorado los diferentes aparatos que producen corriente eléctrica usando la energía de sustancias químicas.
Cuando hablamos de "pila" en general, nos referimos a cualquier dispositivo que genera electricidad continua a partir de una reacción química. Hay varios tipos, como las celdas voltaicas (que no se recargan), las baterías recargables y las pilas de combustible. Cada una tiene sus propias características.
Contenido
- Primeros experimentos con electricidad y el origen del término "batería"
- Primeras baterías prácticas
- Baterías recargables y pilas secas
- Siglo XX: nuevas tecnologías y uso generalizado
- La batería de níquel-hierro (1903)
- La batería alcalina común (1955)
- La pila de mercurio
- La pila de óxido de plata
- La pila de níquel e hidrógeno (años 1970)
- El acumulador de níquel-metal hidruro (finales de 1980)
- La pila de litio (años 1970)
- El acumulador de ion de litio (años 1990)
- La pila de zinc-aire
- Galería de imágenes
- Véase también
Primeros experimentos con electricidad y el origen del término "batería"
La Batería de Bagdad: ¿Un misterio antiguo?
Alrededor de 1927, unos arqueólogos encontraron en un pueblo cerca de Bagdad unas vasijas de barro. Dentro de cada una había un rollo de lámina de cobre que rodeaba una varilla de hierro.
Algunos científicos creen que estos objetos podrían haber sido antiguas pilas de hace unos 2.000 años, y las llamaron la "Batería de Bagdad". Se piensa que un ácido común, como el jugo de limón o el vinagre, pudo haber servido para que funcionaran. Sin embargo, parece que los recipientes no contenían ningún líquido. Réplicas modernas han logrado producir electricidad, lo que apoya esta idea. Si realmente eran baterías, quizás se usaron para cubrir metales con una capa fina de otro metal, para producir pequeñas descargas eléctricas con fines religiosos, o simplemente para guardar rollos antiguos.
La pila de Volta (1780)
En 1780, el científico Luigi Galvani estaba estudiando una rana y notó algo curioso. Cuando tocó la pata de la rana con su bisturí de hierro, la pata se movió como si el animal estuviera vivo. Galvani pensó que la energía venía de la propia pata y la llamó "electricidad animal".
Pero Alessandro Volta, otro científico, no estaba de acuerdo. Él creía que el movimiento se debía al contacto entre dos metales diferentes unidos por algo húmedo. Volta hizo experimentos y publicó sus hallazgos en 1791. En el año 1800, Volta inventó la primera batería que podía producir una corriente eléctrica constante. Esta invención se conoció como la pila voltaica.
La pila voltaica estaba hecha de discos de cobre y zinc apilados uno encima del otro (por eso se llama "pila"). Entre cada par de discos había una capa de tela o cartón empapada en salmuera (agua con sal). A diferencia de otros aparatos de la época, la pila voltaica producía una corriente continua y estable. Volta experimentó con diferentes metales y descubrió que el zinc y la plata funcionaban mejor.
Volta pensaba que la electricidad se generaba solo por el contacto de los metales. Sin embargo, se dio cuenta de que las placas de zinc se corroían más rápido cuando se producía más corriente. Esto hizo que los científicos se dieran cuenta de que las reacciones químicas eran clave para que la batería funcionara.
Los primeros diseños de Volta tenían algunos problemas, como fugas del líquido y cortocircuitos. El inglés William Cruickshank mejoró el diseño colocando los elementos en una caja en lugar de apilarlos. Esto se llamó la batería de artesa. Volta también creó otra versión con vasos llenos de solución salina, unidos por arcos de dos metales diferentes. Esta se conoció como la pila de corona.
Otro problema de las pilas de Volta era que duraban poco. Esto se debía a que se formaban burbujas de hidrógeno en el cobre, lo que aumentaba la resistencia, y a que el zinc se degradaba. En 1835, William Sturgeon descubrió que mezclando un poco de mercurio con el zinc se solucionaba este último problema.
A pesar de sus defectos, las pilas de Volta permitieron muchos experimentos y descubrimientos nuevos, como la electrólisis del agua, que fue realizada por primera vez por Anthony Carlisle y William Nicholson (químico).
Primeras baterías prácticas
La pila Daniell (1836)
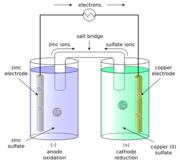
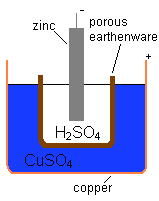
Un químico británico, John Frederic Daniell, buscó una forma de evitar las burbujas de hidrógeno en la pila voltaica. Su solución fue usar un segundo líquido para absorber el hidrógeno. En 1836, inventó la pila Daniell. Esta pila tenía un recipiente de cobre con una solución de sulfato de cobre (II), y dentro, un recipiente de barro sin esmaltar con ácido sulfúrico y un electrodo de zinc. La pared de barro permitía el paso de partículas, pero evitaba que los líquidos se mezclaran.
La pila Daniell producía una corriente más fuerte y confiable que la pila voltaica. Fue muy usada en las redes de telégrafo hasta que fue reemplazada por la pila Leclanché en la década de 1860. Su voltaje era de aproximadamente 1.1 voltios.
La pila de Grove (1839)
La pila de Grove fue inventada por William Robert Grove en 1839. Era una mejora de la pila Daniell. Tenía un electrodo de zinc en ácido sulfúrico y un electrodo de platino en ácido nítrico, separados por barro poroso. La pila de Grove daba una corriente alta y casi el doble de voltaje que la pila Daniell, por lo que fue popular en las redes telegráficas de Estados Unidos. Sin embargo, liberaba vapores tóxicos de dióxido de nitrógeno. Su voltaje era de alrededor de 1.9 voltios.
En 1840, el químico alemán Robert Wilhelm Bunsen mejoró la pila de Grove, cambiando el electrodo de platino por uno de carbono.
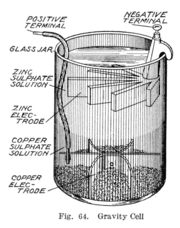
La celda de gravedad (1860)
En la década de 1860, un francés llamado Callaud inventó una versión de la pila Daniell llamada celda de gravedad. Esta versión era más sencilla porque no usaba la barrera porosa, lo que permitía que la batería produjera una corriente más fuerte. Se convirtió en la batería preferida para las redes telegráficas en Estados Unidos y Gran Bretaña, y se usó hasta los años 1950.
La celda de gravedad consistía en un frasco de vidrio con un electrodo de cobre en el fondo y un electrodo de zinc colgado de la parte superior. Se ponían cristales de sulfato de cobre (II) cerca del cobre y el frasco se llenaba con agua destilada. Cuando la pila funcionaba, se formaba una capa de solución de sulfato de zinc en la parte superior. Esta capa se mantenía separada de la de sulfato de cobre por su menor densidad.
Una ventaja era que el técnico podía ver el estado de la pila por el color de las capas. Sin embargo, esta batería solo podía usarse en un lugar fijo, ya que si se movía, los líquidos se mezclaban. Además, necesitaba estar funcionando continuamente para evitar que las soluciones se mezclaran, por lo que no era buena para un uso intermitente.
Baterías recargables y pilas secas
La pila de plomo-ácido: la primera batería recargable (1859)
Hasta este momento, todas las baterías dejaban de funcionar cuando sus sustancias químicas se agotaban. En 1859, Gaston Planté inventó la batería de plomo-ácido, la primera batería que podía recargarse. Esto se lograba haciendo pasar una corriente eléctrica en sentido contrario para que las sustancias químicas se regeneraran.
Una batería de plomo-ácido tiene un electrodo de plomo y otro de dióxido de plomo sumergidos en ácido sulfúrico. Ambos electrodos reaccionan con el ácido para producir sulfato de plomo (II), lo que genera electricidad. Estas reacciones se pueden revertir para recargar la batería.
El primer diseño de Planté consistía en dos placas de plomo enrolladas en espiral. Estas baterías se usaron inicialmente para iluminar vagones de tren. En 1881, Camille Alphonse Faure mejoró el diseño, haciendo que fuera más fácil de producir en masa.
Aunque era pesada y voluminosa para la energía que almacenaba, la batería de Planté podía producir grandes cantidades de corriente. Todavía se usa hoy en día en los automóviles y en otros lugares donde el peso no es un problema. En los años 1970, se desarrolló una versión con un gel en lugar de líquido, lo que permitía usarla en diferentes posiciones sin fugas.
Hoy en día, las baterías se clasifican como "primarias" si solo producen corriente hasta que se agotan, y "secundarias" si se pueden recargar. La batería de plomo-ácido fue la primera batería "secundaria".
La pila Leclanché (1866)
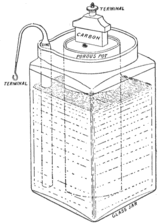
En 1866, Georges Leclanché inventó una batería con un electrodo de zinc y otro de dióxido de manganeso envueltos en un material poroso, todo sumergido en una solución de cloruro de amonio. El dióxido de manganeso se mezclaba con carbono para mejorar la conductividad. Esta pila daba entre 1.4 y 1.6 voltios.
Tuvo mucho éxito en telegrafía, sistemas de señalización y timbres eléctricos. También se usó para los primeros teléfonos. Sin embargo, no podía dar una corriente constante por mucho tiempo. En conversaciones largas, la batería se agotaba, haciendo que la conversación fuera inaudible. Esto se debía a que ciertas reacciones químicas aumentaban la resistencia interna. Estas reacciones se revertían cuando la batería no se usaba, por lo que era buena para un uso intermitente.
La pila de zinc-carbono: la primera pila seca (1887)
En 1887, Carl Gassner patentó una versión de la pila Leclanché que se conoció como la pila seca, porque no tenía un líquido libre. En su lugar, mezcló el cloruro de amonio con yeso para crear una pasta, añadiendo un poco de cloruro de zinc para que durara más. El electrodo de dióxido de manganeso se sumergía en la pasta, y todo estaba dentro de una carcasa de zinc, que también actuaba como electrodo.
A diferencia de las pilas húmedas, la pila seca de Gassner era más resistente, no necesitaba mantenimiento, no se derramaba y podía usarse en cualquier posición. Producía 1.5 voltios. La primera pila seca producida en masa fue el modelo Columbia, lanzado por la National Carbon Company (NCC) en 1896. Esta compañía mejoró el diseño de Gassner, usando cartón en espiral en lugar de yeso, lo que dejaba más espacio para el electrodo y facilitaba el montaje. Fue la primera batería adecuada para el público en general y permitió el desarrollo de dispositivos eléctricos portátiles, como la linterna, que se inventó ese mismo año. La batería de zinc-carbono todavía se fabrica hoy.
Paralelamente, en 1887, Federico Guillermo Luis Hellesen también desarrolló su propio diseño de pila seca.
La batería de níquel-cadmio (1899)
En 1899, un científico sueco llamado Waldmar Jungner inventó la batería de níquel-cadmio, una batería recargable. Tenía electrodos de níquel y cadmio en una solución de hidróxido de potasio. Se empezó a vender en Suecia en 1910 y llegó a Estados Unidos en 1946. Los primeros modelos eran fuertes y almacenaban mucha más energía que las baterías de plomo-ácido, pero eran mucho más caras.
Siglo XX: nuevas tecnologías y uso generalizado
La batería de níquel-hierro (1903)
Waldmar Jungner también inventó una batería de níquel-hierro en 1899, el mismo año que su batería de níquel-cadmio. Sin embargo, esta resultó ser menos eficiente y Jungner no la patentó. Producía mucho más gas hidrógeno al cargarse y el proceso de carga era menos eficiente.
Aun así, Thomas Edison tomó el diseño de la batería de níquel-hierro de Jungner, la patentó y la vendió en 1903. Edison quería crear una batería más ligera y duradera que la de plomo-ácido para los primeros automóviles eléctricos. Aunque su primer modelo tuvo problemas de fugas y poca duración, Edison logró producir un modelo más confiable siete años después. Para entonces, el Ford modelo T ya había hecho que los coches de gasolina fueran los más comunes. A pesar de esto, la batería de Edison tuvo mucho éxito en otras aplicaciones.
La batería alcalina común (1955)
Hasta finales de los años 1950, la batería de zinc-carbono era muy popular, pero su duración era limitada. Las primeras pilas alcalinas eran similares a las de zinc-carbono, pero usaban hidróxido de potasio como líquido. El potasio es un metal alcalino, de ahí el nombre.
En 1955, un ingeniero de la empresa Eveready (ahora Energizer) llamado Lewis Urry buscaba cómo hacer que las baterías de zinc-carbono duraran más. Pero Urry decidió que las pilas alcalinas eran más prometedoras. Hasta ese momento, las pilas alcalinas más duraderas eran demasiado caras. La batería de Urry tenía un electrodo de dióxido de manganeso y un electrodo de zinc en polvo con un líquido alcalino. El zinc en polvo le daba una mayor superficie al electrodo. Estas baterías salieron al mercado en 1959.
Las pilas alcalinas que no se recargan son más caras, pero pueden dar mucha corriente y mantener su rendimiento. Las pilas alcalinas recargables son más baratas que las de níquel-cadmio, retienen bien la carga y funcionan en un amplio rango de temperaturas.
La pila de mercurio
La pila de zinc-óxido de mercurio (II) se conoce como pila de mercurio o pila de botón por su forma pequeña y redonda. Se usaba en audífonos, cámaras y relojes. Su electrodo negativo es de zinc, el positivo de óxido de mercurio (II) y el líquido es una solución de hidróxido de potasio. Produce aproximadamente 1.34 voltios.
Estas pilas son muy dañinas para el ambiente porque contienen mucho mercurio. Por su toxicidad, ya no se permite su venta, aunque se usan como referencia para comparar con otras pilas.
La pila de óxido de plata
La pila de óxido de plata es similar a la pila de mercurio, pero usa óxido de plata en lugar de óxido de mercurio, y produce 1.5 voltios. Son buenas para aparatos que usan poca corriente, como los relojes. Tienen una buena relación energía-peso, pero no funcionan bien a bajas temperaturas. Contienen un pequeño porcentaje de mercurio.
La pila de níquel e hidrógeno (años 1970)
La pila de níquel-hidrógeno se empezó a usar para almacenar energía en satélites de comunicaciones. Utiliza celdas de hidrógeno a alta presión. Se ha pensado que este tipo de pila podría reemplazar a las de níquel-cadmio en algunos usos.
El acumulador de níquel-metal hidruro (finales de 1980)
Las primeras pilas recargables de níquel-metal hidruro (NiMH) para el público general aparecieron en 1989. Son una versión de la batería de níquel-hidrógeno de los años 1970. Las baterías NiMH suelen durar más que las de níquel-cadmio y, como el cadmio es tóxico, las NiMH son menos dañinas para el ambiente.
La pila de litio (años 1970)
El litio es el metal más ligero y tiene un gran potencial para producir electricidad, por lo que es un material ideal para pilas y baterías. No se puede usar un líquido a base de agua porque reaccionaría con el litio. Los experimentos con pilas de litio comenzaron en 1912 con G. N. Lewis, y en los años 1970 se vendieron las primeras baterías de litio.
Actualmente se usan varias pilas con litio en el electrodo negativo y diferentes sustancias en el positivo:
- Pila de litio y sulfuro de hierro (1.6 voltios). Son pequeñas y económicas.
- Pila de litio y dióxido de manganeso (unos 3 voltios). Similares a las anteriores.
- Pila de litio y dióxido de azufre. El electrodo positivo es gaseoso. Se usa en aplicaciones militares.
- Pila de litio y cloruro de tionilo. Funcionan a muy bajas temperaturas, pero deben usarse con cuidado por su toxicidad.
- Pila de litio y monofluoruro de carbono (unos 3.2 voltios). Se usa para pequeños aparatos como cámaras.
El acumulador de ion de litio (años 1990)
En los años 1980, el químico estadounidense John B. Goodenough lideró un equipo de investigación de Sony que finalmente creó la batería de iones de litio. Esta es una versión recargable y más estable de la batería de litio (el litio puro reaccionaba fuertemente con el agua). Las primeras unidades se vendieron en 1991. En estas baterías es importante controlar cómo se cargan y descargan, ya que a temperaturas muy altas pueden tener problemas.
El electrodo positivo suele ser un óxido de cobalto y litio, mientras que el negativo es de carbono poroso. Este electrodo negativo es bastante caro, por lo que se buscan alternativas con níquel, manganeso, o combinaciones de estos metales con iones de aluminio o cromo.
En 1996, se lanzó al mercado la batería de polímero de ion de litio. Estas baterías tienen su líquido en un polímero sólido en lugar de un disolvente líquido. Esto permite que la batería pueda ser flexible y se adapte a la forma de un dispositivo. También almacenan más energía que las baterías de iones de litio normales. Estas ventajas las han hecho muy populares para dispositivos electrónicos portátiles, como teléfonos móviles y PDAs, ya que permiten diseños más flexibles y compactos.
La pila de zinc-aire

Estas pilas se distinguen por tener pequeños agujeros en una de sus caras. Producen un voltaje constante durante toda su vida útil, lo que las hace muy adecuadas para aparatos médicos y de comunicaciones.
Vienen con una lengüeta de plástico de fábrica que cierra los agujeros de entrada de aire hasta que se van a usar. No se debe quitar esta lengüeta antes de usar la pila. Para activarla, simplemente se retira la lengüeta y se espera un minuto para que el aire entre y active los componentes.
Galería de imágenes
Véase también
 En inglés: History of the battery Facts for Kids
En inglés: History of the battery Facts for Kids
- Historia de la electroquímica
- Tipos de pila