Óxido de litio y cobalto para niños
Datos para niños
Óxido de litio y cobalto |
||
|---|---|---|
 |
||
 |
||
| General | ||
| Fórmula molecular | LiCoO2 | |
| Identificadores | ||
| Número CAS | 12190-79-3 | |
| ChemSpider | 74857 | |
| PubChem | 23670860 | |
|
InChI
InChI=InChI=1S/Co.Li.2O/q;+1;;-1
Key: BFZPBUKRYWOWDV-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Masa molar | 97,939029 g/mol | |
El óxido de litio y cobalto, también conocido como cobalato de litio, es un compuesto químico con la fórmula LiCoO2. Es un sólido cristalino de color azul oscuro o gris azulado.
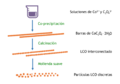
Este material es muy importante porque se usa comúnmente en los electrodos positivos (cátodos) de las baterías de iones de litio. Estas baterías son las que encuentras en tus teléfonos, computadoras portátiles y vehículos eléctricos.
Contenido
Óxido de Litio y Cobalto: El Corazón de tus Baterías
El óxido de litio y cobalto es un componente clave en muchas baterías recargables modernas. Su capacidad para almacenar y liberar energía de manera eficiente lo hace indispensable en la tecnología actual.
¿Qué es el Óxido de Litio y Cobalto?
Es una sustancia formada por tres elementos: litio, cobalto y oxígeno. Los átomos de cobalto en este compuesto tienen una carga específica, lo que le da su nombre completo en química: óxido de cobalto de litio (III).
¿Cómo se Organiza este Material?
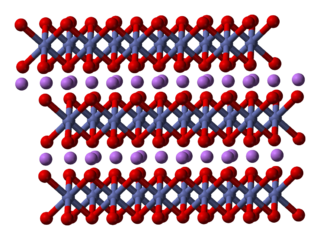
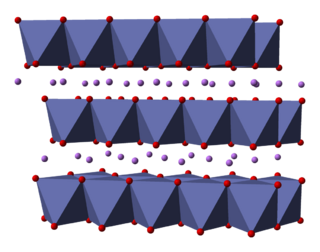
La estructura del LiCoO2 es como un sándwich. Está formado por capas de iones de litio (Li+) que se encuentran entre láminas de átomos de cobalto y oxígeno. Estos átomos se organizan en formas llamadas octaedros.
Dentro de cada capa, los átomos se disponen en una red triangular. Las capas están ligeramente desplazadas para que los átomos de litio estén lejos de los átomos de cobalto. Esta estructura se repite, creando un material muy estable. Los científicos han estudiado esta estructura usando técnicas avanzadas como la difracción de rayos X.
¿Cómo se Fabrica el Óxido de Litio y Cobalto?
Existen varias formas de crear óxido de litio y cobalto. Una manera es calentar una mezcla de carbonato de litio y óxido de cobalto(II,III) (o cobalto metálico) a temperaturas muy altas, entre 600 y 800 °C. Después, se deja enfriar lentamente a 900 °C durante varias horas, todo esto en una atmósfera con oxígeno.
También se pueden obtener partículas muy pequeñas, del tamaño de nanómetros, que son ideales para las baterías. Esto se logra calentando oxalato de cobalto (II) con hidróxido de litio a temperaturas de hasta 750-900 °C.
Otro método usa acetato de litio, acetato de cobalto y ácido cítrico mezclados en agua. Al calentar esta mezcla, se convierte en un gel espeso. Luego, este gel seco se tritura y se calienta poco a poco hasta los 550 °C.
Su Uso en Baterías Recargables
El óxido de litio y cobalto fue descubierto como un material útil para los electrodos de baterías en 1980 por un equipo de investigación en la Universidad de Oxford.
Hoy en día, se usa como el cátodo (el electrodo positivo) en muchas baterías recargables de iones de litio. Durante la carga, el cobalto cambia su estado y algunos iones de litio se mueven hacia el electrolito de la batería.
Las baterías con cátodos de óxido de litio y cobalto (LiCoO2) son muy estables. Sin embargo, su capacidad y potencia pueden ser menores que las de otras baterías que usan óxidos de níquel-cobalto, como las de níquel-aluminio (NCA) o níquel-cobalto-manganeso (NCM).
Aunque las baterías de LiCoO2 son más estables al calor que otras, aún pueden tener problemas si se calientan demasiado (más de 130 °C) o si se sobrecargan. A altas temperaturas, el LiCoO2 puede liberar oxígeno, que reacciona con el líquido dentro de la batería. Esto puede generar mucho calor y ser un problema de seguridad.
¿Por qué es Importante el Cobalto en las Baterías?
El óxido de litio y níquel (LiNiO2), que es similar a los materiales NCA y NCM, no se puede usar solo en baterías porque es inestable. Pierde capacidad rápidamente y tiene problemas de seguridad.
En las baterías que combinan níquel y cobalto (NCM y NCA), el cobalto es crucial. Ayuda a que la estructura de los enlaces entre el níquel y el oxígeno sea más fuerte. Gracias al cobalto, la batería puede almacenar más energía de forma segura.
Otros Materiales para Baterías: NCM y NCA
Además del óxido de litio y cobalto, existen otros materiales importantes para los cátodos de las baterías de iones de litio.
Óxidos de Litio, Níquel, Cobalto y Manganeso (NCM)
Los óxidos de litio, níquel, cobalto y manganeso (conocidos como NCM) son mezclas de estos metales. Su fórmula general es LiNixMnyCo1-x-yO2. Se usan mucho en baterías para dispositivos móviles y vehículos eléctricos.
Los científicos y las empresas están muy interesados en mejorar los NCM para los coches eléctricos. Esto se debe a que pueden almacenar mucha energía y funcionan con un buen voltaje.
También se busca reducir la cantidad de cobalto en los NCM. Esto es importante por el alto costo del cobalto y por algunas preocupaciones sobre cómo se extrae. Además, usar más níquel puede aumentar la capacidad de la batería.
Óxidos de Litio, Níquel, Cobalto y Aluminio (NCA)
Los óxidos de litio, níquel, cobalto y aluminio (conocidos como NCA) son otro grupo de óxidos metálicos mixtos. Son muy importantes para las baterías de iones de litio.
Los NCA se usan como el material activo en el electrodo positivo (el cátodo) de la batería. Están compuestos por iones de litio, níquel, cobalto y aluminio. Su fórmula general es LiNixCoyAlzO2, donde x + y + z = 1.
En las baterías NCA que se usan hoy en día en coches eléctricos y electrodomésticos, la cantidad de níquel (x) es de aproximadamente 0.8. Estas baterías suelen tener un voltaje entre 3.6 V y 4.0 V. Por ejemplo, una versión común en 2019 era LiNi0.84Co0.12Al0.04O2.
Galería de imágenes
Véase también
 En inglés: Lithium cobalt oxide Facts for Kids
En inglés: Lithium cobalt oxide Facts for Kids