Sulfato de zinc para niños
Datos para niños
Sulfato de zinc |
||
|---|---|---|
Zn2+ + 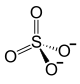 |
||
 |
||
| Nombre IUPAC | ||
| Tetraoxosulfato (VI) de zinc | ||
| General | ||
| Otros nombres | Vitriolo blanco Goslarita Vitriolo de Goslar Caparrosa blanca |
|
| Fórmula semidesarrollada | ZnSO4 (anhidro) ZnSO4.H2O (monohidrato) ZnSO4.6 H2O (hexahidrato) ZnSO4.7 H2O (heptahidrato) |
|
| Fórmula estructural |  |
|
| Fórmula molecular | ZnSO4 | |
| Identificadores | ||
| Número CAS | 7733-02-0 (sal anhidra) 7446-19-7 ( |
|
| ChEBI | 35176 | |
| ChEMBL | CHEMBL1200929 | |
| ChemSpider | 22833 | |
| DrugBank | DB09322 | |
| PubChem | 24424 | |
| UNII | 0J6Z13X3WO | |
|
InChI
InChI=InChI=1S/H2O4S.Zn/c1-5(2,3)4;/h(H2,1,2,3,4);/q;+2/p-2
Key: NWONKYPBYAMBJT-UHFFFAOYSA-L |
||
| Propiedades físicas | ||
| Apariencia | Polvo blanco cristalino, inodoro. | |
| Densidad | 3,74×10³ (anhidro) kg/m³; 1,957 (heptahidrato) g/cm³ | |
| Masa molar | 161,454 (anhidro) 287,55 (heptahidrato) g/mol |
|
| Punto de fusión | 373 K (100 °C) | |
| Punto de ebullición | Se descompone por encima de 773 K (500 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | Muy soluble en agua. Soluble en metanol y glicerol. Ligeramente soluble en etanol | |
| Termoquímica | ||
| ΔfH0sólido | -982,8 kJ/mol | |
| S0sólido | 110.5 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
0
2
1
|
|
| Frases R | R22- Nocivo por ingestión. R41- Riesgo de lesiones oculares graves. R50- Muy tóxico para los organismos acuáticos. R53- Puede provocar a largo plazo efectos negativos en el medio ambiente acuático. |
|
| Frases S |
S2- Manténgase fuera del alcance de los niños. S61- Evítese su liberación al medio ambiente. Recábense instrucciones específicas de la ficha de datos de seguridad. |
|
| Riesgos | ||
| Ingestión |
Nocivo leve. Dolor abdominal, náuseas, vómitos y diarrea. Irritaciones en la boca y tracto digestivo. Daño a los riñones. Pancreatitis. En casos extremos, convulsiones, variaciones de presión y coma. Dosis letal humano: 180 mg/kg (zinc Sulfato Anhidro). |
|
| Inhalación | Irritaciones en el tracto respiratorio. Tos y dificultad respiratoria. | |
| Piel | Irritaciones. Enrojecimiento, picazón y dolor. | |
| Ojos | Irritaciones. Enrojecimiento y dolor. | |
| LD50 | DL50 (oral - tasa): 2949 mg/kg (zinc Sulfato Anhidro). | |
| Más información | Hazardous Chemical Database | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El sulfato de zinc es un compuesto químico que se ve como un polvo blanco y cristalino. Es incoloro y se disuelve fácilmente en agua. Su fórmula química es ZnSO4. A menudo, este compuesto tiene moléculas de agua unidas a él.
También se le conoce por otros nombres como vitriolo blanco o caparrosa blanca.
Contenido
¿Qué es el sulfato de zinc y cómo se presenta?
El sulfato de zinc es un compuesto químico que combina zinc, azufre y oxígeno. Se encuentra en la naturaleza y también se puede fabricar.
Formas del sulfato de zinc
Este compuesto puede presentarse de varias maneras, dependiendo de cuántas moléculas de agua tenga unidas:
- La forma más común es el sulfato de zinc heptahidratado (ZnSO4·7H2O). Esto significa que tiene siete moléculas de agua.
- Si se calienta a 30 °C, pierde una molécula de agua y se convierte en ZnSO4·6H2O.
- A 70 °C, pierde cinco moléculas más de agua, quedando como ZnSO4·H2O.
- Finalmente, a 280 °C, pierde la última molécula de agua y se convierte en la forma anhidra (sin agua).
¿Cómo se obtiene el sulfato de zinc?
El sulfato de zinc se puede encontrar en la naturaleza o se puede fabricar en laboratorios e industrias.
Origen natural del sulfato de zinc
En la naturaleza, el sulfato de zinc se encuentra en minerales como la goslarita y la bianchita. La goslarita es la forma heptahidratada y se conoce como "vitriolo blanco".
Fabricación del sulfato de zinc
Se puede producir de varias maneras:
- Reaccionando zinc o óxido de zinc con ácido sulfúrico en agua.
- Oxidando el sulfuro de zinc, que es un componente de un mineral llamado blenda.
- Añadiendo zinc a soluciones de sulfato de cobre (II) o sulfato de hierro (II). En estas reacciones, el zinc reemplaza al cobre o al hierro.
¿Para qué se utiliza el sulfato de zinc?
El sulfato de zinc tiene muchos usos importantes en diferentes áreas.
Usos en la agricultura y ganadería
- Se añade a la comida de los animales como un suplemento de zinc. El zinc es un mineral esencial para su crecimiento y salud.
- Se usa para fabricar abonos y productos para rociar cultivos. Ayuda a las plantas a crecer fuertes.
Usos industriales y en el hogar
- Se utiliza en la fabricación de litopón, que es un pigmento blanco.
- También se usa para producir rayón, que es un tipo de seda artificial.
- Sirve como conservante para la madera, ayudando a protegerla.
- Se emplea en procesos de zincado, que es cuando se recubre un metal con una capa de zinc para protegerlo.
- Actúa como mordiente en la coloración, lo que ayuda a que los tintes se fijen mejor en las telas.
- Se usa para preservar pieles y cuero.
- Una solución de sulfato de zinc es útil para quitar el musgo de los pavimentos.
Usos en medicina
En medicina, el sulfato de zinc se ha usado por sus propiedades astringentes (que ayudan a contraer los tejidos) y eméticas (que provocan el vómito).
Véase también
 En inglés: Zinc sulfate Facts for Kids
En inglés: Zinc sulfate Facts for Kids


