Historia de la electroquímica para niños
La Historia de la electroquímica es el relato de cómo esta importante rama de la fisicoquímica ha evolucionado a lo largo del tiempo. Desde los primeros descubrimientos sobre los imanes en los siglos XVI y XVII, hasta las teorías más avanzadas sobre la electricidad y las reacciones químicas en el siglo XIX, la electroquímica ha crecido mucho. Hoy en día, sigue siendo un campo de estudio muy activo, con investigaciones en áreas como las baterías solares, la protección de metales y técnicas biológicas como la electroforesis.
Contenido
¿Cómo empezó el estudio de la electroquímica?
Es difícil saber exactamente cuándo comenzó la electroquímica, ya que hay pruebas de que existieron baterías y formas de almacenar energía eléctrica desde la antigüedad. Por ejemplo, en la década de 1930, se encontraron objetos en el antiguo imperio Parto (alrededor del siglo III d.C.) que parecían ser baterías. Es posible que se usaran para recubrir metales con otros metales, un proceso llamado electrodeposición o galvanizado. Sin embargo, las personas de esa época no tenían teorías científicas para explicar lo que hacían, por lo que no se puede hablar de electroquímica como una ciencia.
Primeros pasos en el Renacimiento
Los primeros avances importantes en la teoría eléctrica comenzaron en el siglo XVI con el científico inglés William Gilbert. Él dedicó 17 años a experimentar con el magnetismo y la electricidad. Por su trabajo con el magnetismo, Gilbert es conocido como el "Padre del magnetismo". Descubrió varias maneras de crear imanes y hacerlos más fuertes.
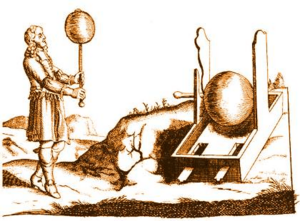
En 1663, el físico alemán Otto von Guericke construyó el primer generador eléctrico. Esta máquina producía electricidad estática al frotar una esfera de azufre que giraba. Al tocar la esfera con una superficie de goma, se generaban chispas de electricidad.
A mediados del siglo XVIII, el químico francés Charles François de Cisternay du Fay propuso que la electricidad estaba formada por dos tipos de "fluidos": uno positivo (como el vidrio) y otro negativo (como la resina). Esta idea de dos fluidos era diferente a la de Benjamin Franklin, quien pensaba que solo había un tipo de fluido eléctrico.
Las ideas de Charles-Augustin de Coulomb sobre la atracción eléctrica en 1781 y los estudios de Joseph Priestley en Inglaterra ayudaron a preparar el camino para el nacimiento científico de la electroquímica.
El descubrimiento de Galvani y la controversia con Volta
A finales del siglo XVIII, el médico italiano Luigi Galvani hizo un descubrimiento clave. Observó que al aplicar electricidad a las ancas de rana, estas se movían. También notó que si tocaba los nervios de las ancas con un escalpelo descargado, ocurría el mismo movimiento. Publicó sus observaciones en 1791, sugiriendo que existía una sustancia "nervio-eléctrica" en todos los seres vivos.
Galvani creyó que esta era una nueva forma de electricidad natural, similar a la de los rayos o la de animales como la anguila eléctrica. Sus colegas aceptaron sus ideas, pero otro científico italiano, Alessandro Volta, no estuvo de acuerdo. Volta pensó que el movimiento de las ancas de rana se debía a las diferencias entre los metales del escalpelo de Galvani. Galvani le demostró que el mismo efecto ocurría usando dos piezas del mismo material.
Avances durante la Revolución Industrial
En 1800, los químicos ingleses William Nicholson y Johann Wilhelm Ritter lograron separar el agua en hidrógeno y oxígeno usando electricidad, un proceso llamado electrólisis. Poco después, Ritter descubrió la galvanoplastia, que es el recubrimiento de un objeto con una capa de metal usando electricidad.
Ritter también notó que la cantidad de metal depositado y de hidrógeno producido durante la electrólisis dependía de la distancia entre los electrodos. En 1801, observó el fenómeno de la termoelectricidad, que es la producción de electricidad por diferencias de temperatura.
Grandes descubrimientos del siglo XIX
Los experimentos continuaron en las primeras décadas del siglo XIX. En 1810, William Hyde Wollaston mejoró la pila de Volta.
El trabajo de Humphry Davy con la electrólisis demostró que la electricidad en las celdas electroquímicas se producía por reacciones químicas entre sustancias con cargas opuestas. Gracias a esto, pudo aislar elementos como el sodio y el potasio de sus sales.
En 1820, Hans Christian Ørsted descubrió que una corriente eléctrica podía crear un campo magnético, un avance muy importante en el electromagnetismo. Más tarde, André-Marie Ampère repitió el experimento de Ørsted y lo explicó con fórmulas matemáticas.
Casi al final de esa década, más científicos contribuyeron a la teoría de la electricidad, como Georg Ohm con su famosa ley de Ohm en 1827.
Esto sentó las bases para que en 1832, Michael Faraday pudiera establecer las dos leyes más importantes de la electrólisis, conocidas como las leyes de Faraday. En 1836, John Daniell inventó la primera celda electroquímica que no necesitaba hidrógeno, dando origen a la batería de zinc y cobre.
Las celdas de combustible también surgieron en esta época, cuando William Grove creó la primera en 1839.
El avance más significativo en electroquímica de esta época ocurrió en 1866, cuando Georges Leclanché patentó una pila de carbón más pequeña que las anteriores. Su invento fue el precursor de la pila de zinc-carbono, una de las más usadas en la historia.
En 1886, Paul Héroult y Charles M. Hall desarrollaron un método crucial para obtener aluminio metálico usando los principios de Faraday. Este proceso, llamado proceso Hall-Héroult, todavía se usa hoy para extraer aluminio de minerales como la bauxita.
A finales del siglo XIX, científicos importantes establecieron nuevas teorías gracias a la electroquímica. Svante August Arrhenius propuso su ley de disociación electrolítica en 1884. Demostró que las sustancias disueltas en agua se separan en partículas con carga eléctrica (iones) que se mueven hacia los electrodos. Más tarde, en 1894, Friedrich Ostwald llegó a conclusiones similares sobre la disociación de ácidos orgánicos.
Walther Hermann Nernst desarrolló la teoría de la fuerza electromotriz (fem) de las celdas voltaicas en 1888. Un año después, al analizar la energía involucrada, estableció lo que hoy conocemos como la ecuación de Nernst.
Siglo XX y avances recientes
El siglo XX vio el nacimiento de la Sociedad Electroquímica en 1902. Una de las contribuciones más importantes de la electroquímica ocurrió en 1909, cuando sirvió de base para que Robert Andrews Millikan pudiera determinar la carga eléctrica del electrón con su famoso experimento de la gota de Millikan.
En 1923, Johannes Nicolaus Brønsted y Thomas Martin Lowry publicaron su teoría de ácidos y bases, usando celdas electroquímicas de manera similar a Arrhenius.
En el campo de la biología y la medicina, hubo avances en 1937, cuando Arne Tiselius desarrolló el primer aparato sofisticado de electroforesis. Años más tarde, en 1948, recibió el Premio Nobel de Química por su trabajo en la electroforesis de proteínas.
En 1949 se fundó la Sociedad Internacional de Electroquímica. Entre 1960 y 1970, se desarrolló una nueva área de estudio llamada electroquímica cuántica, iniciada por Revaz Dogonadze y sus estudiantes. Más tarde, esta disciplina se hizo más conocida por los trabajos de Rudolph A. Marcus en Estados Unidos en 1990.
|
Véase también
 En inglés: History of electrochemistry Facts for Kids
En inglés: History of electrochemistry Facts for Kids


