Acetato de sodio para niños
Datos para niños
Acetato de sodio |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Etanoato de sodio | ||
| General | ||
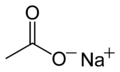
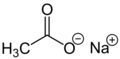
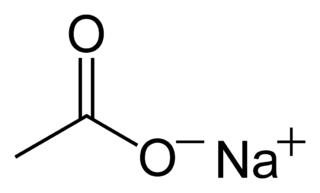
| Fórmula semidesarrollada | <chem>CH3COONa</chem> | |
| Fórmula estructural | 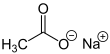 |
|
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS |
127-09-3 (Anhidrido) 6131-90-4 (Trihidratado) |
|
| ChEBI | 32954 | |
| ChEMBL | CHEMBL1354 | |
| ChemSpider | 29105 | |
| DrugBank | DB09395 | |
| PubChem | 517045 | |
| UNII | NVG71ZZ7P0 | |
|
InChI
InChI=InChI=1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1
Key: VMHLLURERBWHNL-UHFFFAOYSA-M |
||
| Propiedades físicas | ||
| Densidad | 1450 kg/m³; 1,45 g/cm³ | |
| Masa molar | 82,04 g/mol | |
| Punto de ebullición | 610 K (337 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El acetato de sodio, también conocido como etanoato de sodio, es una sustancia química muy útil. Es la sal de sodio del ácido acético, que es el componente principal del vinagre. Este compuesto es bastante económico y se produce en grandes cantidades para muchos usos diferentes.
Contenido
Acetato de Sodio: Un Compuesto Versátil
El acetato de sodio es un químico con muchas aplicaciones en nuestra vida diaria y en la industria. Desde la fabricación de telas hasta la comida que comemos, este compuesto juega un papel importante.
Usos del Acetato de Sodio en la Industria
El acetato de sodio se utiliza en varias industrias debido a sus propiedades especiales.
En la Fabricación de Telas y Caucho
En la industria textil, el acetato de sodio ayuda a neutralizar los residuos de ácido sulfúrico que quedan de algunos procesos. También se usa para proteger los colores cuando se tiñen telas con ciertos colorantes. Además, es útil en el proceso de curtido de pieles. En la producción de caucho sintético, ayuda a controlar la velocidad de un proceso llamado vulcanización.
Como Conservante y Saborizante de Alimentos
¿Alguna vez has comido patatas fritas con sabor a sal y vinagre? Es muy probable que el acetato de sodio sea el responsable de ese sabor. Se etiqueta con el código E 262 I en los alimentos. También se añade a muchos alimentos como conservante, ayudando a que duren más tiempo. En este caso, se le llama diacetato de sodio y se etiqueta con el código E 262 II.
Manteniendo el Equilibrio Químico
En campos como la bioquímica, donde las reacciones son muy sensibles al nivel de acidez (pH), el acetato de sodio es muy valioso. Combinado con ácido acético, puede formar una "disolución tampón". Esto significa que ayuda a mantener el pH de una mezcla casi constante, lo cual es crucial para que muchas reacciones funcionen correctamente.
¿Cómo Funciona el "Hielo Caliente"?
Una de las aplicaciones más curiosas del acetato de sodio es en las bolsas térmicas que se calientan solas, a veces llamadas "hielo caliente".
La Ciencia Detrás de las Bolsas Térmicas
Estas bolsas contienen una forma especial de acetato de sodio que tiene agua en su estructura (acetato de sodio trihidratado). Cuando calientas estos cristales a unos 100 °C, se derriten. Si luego los dejas enfriar lentamente, se forma una disolución que está "supersaturada". Esto significa que hay más acetato de sodio disuelto de lo que normalmente sería posible a esa temperatura.
La disolución puede permanecer líquida incluso por debajo de su punto de fusión. Para activarla, solo tienes que presionar un pequeño disco metálico dentro de la bolsa. Esto crea un punto donde los cristales pueden empezar a formarse. Cuando el acetato de sodio vuelve a su estado sólido, libera calor. Por eso, la bolsa se calienta rápidamente, ¡como si fuera "hielo caliente"! Es muy útil para calentar las manos o aplicar calor en alguna parte del cuerpo.
¿Cómo se Obtiene el Acetato de Sodio?
El acetato de sodio es un compuesto bastante fácil de conseguir. Generalmente, las empresas lo compran a proveedores de productos químicos.
Reacciones Químicas Sencillas
Aunque se compra mucho, también se puede fabricar en un laboratorio. Una forma común de hacerlo es mezclando ácido acético (el del vinagre) con sustancias que contienen sodio, como el carbonato de sodio, el bicarbonato de sodio (el que usas para hornear) o el hidróxido de sodio.
Una reacción muy conocida es la del bicarbonato de sodio con el vinagre: <chem>CH3COOH{_{(l)}} + NaHCO3{_{(s)}} -> CH3COO{^{-}}{_{(aq)}} + Na{^{+}}{_{(aq)}} + H2O{_{(l)}} + CO2\uparrow{_{(g)}} </chem> Cuando mezclas bicarbonato de sodio con vinagre, verás burbujas de dióxido de carbono (CO2). Después de esta reacción, si evaporas el agua, puedes obtener cristales de acetato de sodio. Por ejemplo, 84 gramos de bicarbonato de sodio y 750 gramos de vinagre (con 8% de ácido acético) pueden producir unos 82 gramos de acetato de sodio disuelto.
Otra forma de obtenerlo es reaccionando ácido acético con hidróxido de sodio.
El Acetato de Sodio en la Cocina
Además de ser un conservante y saborizante, el acetato de sodio ha encontrado un lugar en la cocina de alta gastronomía.
En un congreso de cocina en Sevilla en 2011, un chef llamado José Carlos García, con la ayuda de un químico, creó un plato llamado "Concha Fina Margarita". Para presentarlo, usó la capacidad del acetato de sodio de pasar de líquido a sólido de forma espectacular. Esto creaba una especie de "falso hielo" que servía de base para el plato, sorprendiendo a los comensales.
Galería de imágenes
Véase también
 En inglés: Sodium acetate Facts for Kids
En inglés: Sodium acetate Facts for Kids