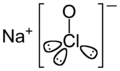
Hipoclorito de sodio para niños
Datos para niños
Hipoclorito de sodio |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Hipocloroso | ||
| General | ||
| Otros nombres | Hipoclorito sódico | |
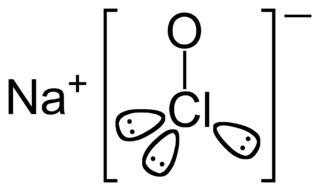
| Fórmula estructural | 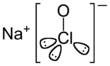 |
|
| Fórmula molecular | NaClO | |
| Identificadores | ||
| Número CAS | 7681-52-9 | |
| ChEBI | 32146 | |
| ChEMBL | CHEMBL1334078 | |
| ChemSpider | 22756 | |
| PubChem | 24340 | |
| UNII | DY38VHM5OD | |
| KEGG | D01711 | |
|
InChI
InChI=InChI=1S/ClO.Na/c1-2;/q-1;+1
Key: SUKJFIGYRHOWBL-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Verde (líquido, diluido). Blanco (Sólido) | |
| Densidad | 1110 kg/m³; 1,11 g/cm³ | |
| Masa molar | 74,44 g/mol | |
| Punto de fusión | 291 K (18 °C) | |
| Punto de ebullición | 374 K (101 °C) | |
| Propiedades químicas | ||
| Acidez | <7 pKa | |
| Solubilidad en agua | 29.3 g/100mL (0 °C) | |
| Peligrosidad | ||
| SGA |   |
|
| NFPA 704 |
0
2
2
OX
|
|
| Frases S | S1/2, S28, S45, S50, S61 | |
| Riesgos | ||
| Riesgos principales | Hazardous Chemical Database (en inglés) | |
| Ingestión | Peligroso en grandes cantidades. | |
| Inhalación | Peligroso en grandes concentraciones. | |
| Piel | Causa quemaduras químicas y cáncer de piel en grandes cantidades. | |
| Ojos | Causa quemaduras químicas. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El hipoclorito de sodio, también conocido como hipoclorito sódico, es un compuesto químico muy útil. Cuando se disuelve en agua, lo conocemos por diferentes nombres como lejía, cloro o lavandina, dependiendo del lugar.
Su fórmula química es NaClO. Es un oxidante fuerte, lo que significa que puede quitar electrones a otras sustancias. Por esta razón, se usa mucho para desinfectar y para blanquear telas, ya que puede destruir muchos colores.
La lejía debe manejarse con cuidado. Su estabilidad depende de varios factores. Por ejemplo, es más estable si está menos concentrada o si se guarda en un lugar fresco. No debe mezclarse con otras sustancias, especialmente con ácidos o amoníaco. Si se mezcla con amoníaco, puede formar un gas muy peligroso.
Contenido
Historia del Hipoclorito de Sodio
¿Quién descubrió el cloro y la lejía?
El cloro fue descubierto por Carl Wilhelm Scheele. Él notó que este gas podía quitar el color a muchas plantas. Sin embargo, el cloro gaseoso era difícil de usar porque era asfixiante.
Más tarde, en 1785, Claude Louis Berthollet investigó cómo usar el cloro disuelto en agua para blanquear telas. Aun así, el cloro se liberaba. Para mejorar esto, Leonard Alban y Mathieu Vallet, dueños de una fábrica en Javel (cerca de París), hicieron pasar el cloro por una solución de carbonato de potasio. Así crearon el "agua de Javel", que fue un gran avance.
En 1799, Charles Tennant obtuvo una patente para producir hipoclorito de calcio. Construyó una fábrica que se convirtió en una de las más grandes del mundo.
Usos tempranos como desinfectante
Desde finales del siglo XVIII, el hipoclorito también empezó a usarse para desinfectar. El médico francés Pierre-François Percy y el farmacéutico Antoine Germain Labarraque fueron pioneros en esto. A Labarraque se le atribuye la idea de usar sodio en lugar de potasio para hacer una solución más efectiva.
En México, Francisco Montes de Oca fue un cirujano que, desde 1860, promovió lavar las manos y las heridas con una solución similar a la de Labarraque. Esto ayudó mucho a mantener la limpieza en los hospitales de campaña.
¿Cómo se presenta el Hipoclorito de Sodio?
El hipoclorito de sodio puede encontrarse en forma sólida, como un polvo blanco. Sin embargo, lo más común es verlo disuelto en agua, formando un líquido que puede ser de color verde claro cuando está diluido.
Cuando el hipoclorito de sodio se disuelve en agua, con el tiempo, sus componentes se van transformando. Esto significa que su capacidad para desinfectar puede disminuir si no se almacena correctamente o si pasa mucho tiempo.
Usos Comunes del Hipoclorito de Sodio
Limpieza y desinfección en el hogar
La lejía es muy popular en los hogares. Se usa para limpiar y desinfectar superficies, baños y ropa. Es muy efectiva para eliminar hongos y bacterias.
Tratamiento de agua
El hipoclorito de sodio es fundamental para hacer que el agua sea segura para beber. Se añade al agua para eliminar microorganismos dañinos. También se usa para desinfectar piscinas, ya sea directamente o a través de sistemas que lo producen a partir de sal.
Otros usos importantes
Este compuesto también se utiliza en laboratorios para identificar ciertas especies de animales marinos. Disuelve la materia orgánica, dejando al descubierto estructuras duras que son únicas para cada especie. Además, se usa en la industria textil para blanquear telas.
Nombres Populares del Hipoclorito de Sodio
La solución acuosa de hipoclorito de sodio tiene muchos nombres diferentes según el país:
- En España y Perú se le llama lejía.
- En Chile, México, Colombia, Costa Rica y Venezuela se le conoce como cloro.
- En algunas partes de Colombia también se le dice blanqueador o límpido.
- En Uruguay es común el nombre Agua Jane®.
- En Argentina se le llama lavandina.
- En Bolivia se usan tanto cloro como lavandina.
Galería de imágenes
Véase también
 En inglés: Sodium hypochlorite Facts for Kids
En inglés: Sodium hypochlorite Facts for Kids