Base (química) para niños
Una base o álcali (palabra que viene del árabe y significa 'ceniza') es una sustancia química que tiene propiedades especiales, llamadas propiedades alcalinas. Imagina que es lo contrario de un ácido. Cuando una base se disuelve en agua, libera unas partículas muy pequeñas llamadas iones hidroxilo (OH-). Por ejemplo, el hidróxido de potasio (KOH) es una base que, al disolverse en agua, libera iones OH-.
<chem>KOH_{(aq)} \longrightarrow {K^+}_{(aq)} + {OH^-}_{(aq)}</chem>
Para saber qué tan básica (o alcalina) es una sustancia en agua, usamos una escala llamada pH. Esta escala nos ayuda a medir tanto la acidez como la basicidad. Un pH de 7 es neutro (como el agua pura), un pH menor de 7 es ácido, y un pH mayor de 7 es básico.
Contenido
¿Qué son las bases? Diferentes ideas
A lo largo de la historia, los científicos han tenido varias ideas sobre qué es una base. Aquí te explicamos las más importantes:
La idea de Arrhenius
En 1887, un químico llamado Svante August Arrhenius propuso que una base es una sustancia que, cuando se disuelve en agua, libera iones hidroxilo (OH-). Piensa en el hidróxido de sodio (NaOH), que al disolverse en agua, se separa en iones sodio (Na+) y iones hidroxilo (OH-). <chem>NaOH -> Na+ + OH-</chem> Otros ejemplos de bases según Arrhenius son el hidróxido de potasio (KOH) y el hidróxido de aluminio (Al(OH)3).
La idea de Brønsted y Lowry
En 1923, dos químicos, Johannes Nicolaus Brønsted y Thomas Martin Lowry, tuvieron una idea más amplia. Ellos dijeron que una base es cualquier sustancia que puede aceptar un protón (H+). Un protón es una partícula muy pequeña con carga positiva. Esta idea es útil porque funciona no solo en agua, sino también en otros líquidos. Por ejemplo, el amoníaco (NH3) es una base según esta teoría, porque puede aceptar un protón. <chem>NH3 + H2O -> NH4+ + OH-</chem> En esta reacción, el agua (H2O) actúa como un ácido al donar un protón al amoníaco.
La idea de Lewis
También en 1923, otro químico, Gilbert N. Lewis, propuso una idea aún más general. Según Lewis, una base es una sustancia que puede donar un par de electrones. Los electrones son partículas con carga negativa. El ion OH-, el amoníaco (NH3) y el agua (H2O) son ejemplos de bases de Lewis porque tienen pares de electrones que pueden donar. Todas las bases de Arrhenius y Brønsted-Lowry también son bases de Lewis.
Propiedades de las bases
Las bases tienen características que las hacen únicas:
- Sensación jabonosa: Si tocas una base diluida (¡con mucho cuidado y bajo supervisión!), sentirás que es resbaladiza, como el jabón. Esto se debe a que reaccionan con la grasa de tu piel.
- Corrosivas: Las bases fuertes o muy concentradas son peligrosas. Pueden quemar o dañar la materia orgánica, como tu piel. Por eso, siempre hay que manejarlas con precaución.
- Conducen electricidad: Cuando se disuelven en agua, las bases se separan en iones, lo que permite que la corriente eléctrica pase a través de la solución.
- Cambian de color los indicadores: Las bases hacen que el papel de tornasol rojo se vuelva azul. También hacen que la fenolftaleína se ponga de color rosa.
- Sabor amargo: Las bases tienen un sabor amargo característico. ¡Pero nunca debes probar una sustancia química para saber si es una base!
¿Cómo se forman las bases?
Una forma común de que se forme una base es cuando un óxido metálico (un metal combinado con oxígeno) reacciona con agua. Por ejemplo: 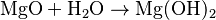 Aquí, el óxido de magnesio (MgO) reacciona con agua para formar hidróxido de magnesio (Mg(OH)2), que es una base.
Aquí, el óxido de magnesio (MgO) reacciona con agua para formar hidróxido de magnesio (Mg(OH)2), que es una base.
Nomenclatura de bases: ¿Cómo se nombran?
Para nombrar las bases, generalmente se usa la palabra "hidróxido" seguida del nombre del elemento metálico al que está unido el grupo OH. A veces, se usan prefijos o números romanos para indicar cuántos grupos OH hay o la valencia del metal.
| Fórmula | Tradicional | Stock | IUPAC |
|---|---|---|---|
| CuOH | Hidróxido cuproso | Hidróxido de cobre (I) | Hidróxido de cobre |
| Cu(OH)2 | Hidróxido cúprico | Hidróxido de cobre (II) | Dihidróxido de cobre |
Ejemplos de bases comunes
Seguro que conoces algunas bases de tu vida diaria:
- Soda cáustica (NaOH): Se usa en productos de limpieza de desagües.
- Leche de magnesia (Mg(OH)2): Un Antiácido que ayuda a aliviar la acidez estomacal.
- Amoníaco (NH3): Presente en muchos limpiadores de hogar.
- Jabón y detergentes: Hacen que la grasa se disuelva en el agua.
- Bicarbonato de sodio (NaHCO3): Se usa para cocinar y también como antiácido suave.
- Cloro de piscina (NaClO): Ayuda a mantener el agua limpia.
Bases y la escala de pH
El pH es una forma de medir qué tan ácida o básica es una solución. La escala de pH va de 0 a 14.
- Un pH de 7 es neutro (como el agua pura).
- Un pH menor de 7 es ácido.
- Un pH mayor de 7 es básico.
Las bases, al liberar iones OH- o aceptar iones H+, hacen que la concentración de iones H+ en una solución disminuya. Esto provoca que el pH de la solución aumente, volviéndola más básica. Por ejemplo, una solución de hidróxido de sodio puede tener un pH de 14, que es muy básico.
Neutralización de bases
Cuando una base se mezcla con un ácido, ocurre una reacción de neutralización. En esta reacción, el ácido y la base se "cancelan" mutuamente, formando sal y agua. Por ejemplo, si mezclas hidróxido de sodio (una base fuerte) con ácido clorhídrico (un ácido fuerte): <chem>NaOH -> Na+ + OH-</chem> (La base se disocia) <chem>HCl -> H+ + Cl-</chem> (El ácido se disocia) Cuando se juntan, los iones H+ del ácido y los iones OH− de la base se unen para formar moléculas de agua: <chem>H+ + OH- -> H2O</chem> La reacción general es:
|
Es importante saber que, para neutralizar un derrame de ácido, siempre se deben usar bases débiles (como el bicarbonato de sodio). Usar una base fuerte podría causar una reacción muy violenta y peligrosa.
Bases fuertes y débiles
Las bases se clasifican en fuertes o débiles según qué tan bien se disuelven y liberan iones OH- en el agua:
Bases fuertes
Una base fuerte es aquella que se disuelve completamente en agua, liberando la mayor cantidad posible de iones OH-. Esto significa que casi todas sus moléculas se separan en iones. Por ejemplo, el hidróxido de potasio (KOH) es una base fuerte: <chem>KOH -> K+ + OH-</chem> (en disolución acuosa) Otros ejemplos de bases fuertes son los hidróxidos de los metales alcalinos y las tierras alcalinas, como el hidróxido de sodio (NaOH) y el hidróxido de calcio (Ca(OH)2).
Bases débiles
Una base débil también libera iones OH- en el agua, pero no se disuelve completamente. Solo una parte de sus moléculas se separa en iones, y el resto permanece sin disociar. Hay un equilibrio entre las moléculas que se disocian y las que no. Por ejemplo, el hidróxido de aluminio (Al(OH)3) es una base débil: <chem>Al(OH)3 <=> Al^3+ + 3OH-</chem> Esto significa que el hidróxido de aluminio se está descomponiendo y formando continuamente.
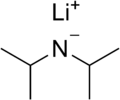
Superbases
Existen bases aún más fuertes que las bases fuertes, llamadas superbases. Estas bases son tan potentes que no pueden existir en soluciones de agua, porque reaccionarían inmediatamente con el agua. Se usan en química para reacciones muy específicas donde se necesita una base extremadamente fuerte. Algunos ejemplos de superbases son el N-butilo-litio (n-BuLi) y la Diisopropilamida de litio.
Bases como catalizadores
Las bases también se usan como catalizadores en muchas reacciones químicas. Un catalizador es una sustancia que acelera una reacción sin consumirse en ella. Algunos óxidos metálicos, como el óxido de magnesio y el óxido de calcio, actúan como catalizadores básicos. Muchos metales de transición también son buenos catalizadores básicos.
Galería de imágenes
Véase también
 En inglés: Base (chemistry) Facts for Kids
En inglés: Base (chemistry) Facts for Kids