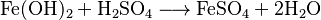Sulfato de hierro(II) para niños
El sulfato de hierro(II) es un compuesto químico iónico con la fórmula FeSO4. También se le conoce como sulfato ferroso, caparrosa verde o vitriolo verde. Este compuesto se encuentra a menudo en forma de cristales de color azul-verdoso, que contienen siete moléculas de agua (FeSO4·7 H2O).
Datos para niños
Sulfato de hierro(II) |
||
|---|---|---|
 |
||
| Nombre IUPAC | ||
| Tetraoxi)]-dosulfato-(2S, 5S)-hierro | ||
| General | ||
| Otros nombres | Sulfato ferroso Tetraoxosulfato(VI) de hierro(II) Vitriolo verde Vitriolo de hierro Caparrosa verde Melanterita Szomolnokita |
|
| Fórmula semidesarrollada | FeSO4 (sal anhidra) FeSO4·H2O (monohidrato) FeSO4·4H2O (tetrahidrato) FeSO4·5H2O (pentahidrato) FeSO4·7H2O (heptahidrato) |
|
| Fórmula estructural | Fe2+ + 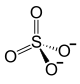 |
|
| Fórmula molecular | FeSO4 | |
| Identificadores | ||
| Número CAS | 7720-78-7(sal anhidra) (monohidrato) ( |
|
| ChEBI | 75832 | |
| ChEMBL | CHEMBL1200830 | |
| ChemSpider | 22804 | |
| DrugBank | DB13257 | |
| PubChem | 24393 | |
| UNII | 2IDP3X9OUD | |
|
InChI
InChI=InChI=1S/Fe.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2E/p-2
Key: BAUYGSIQEAFULO-UHFFFAOYSA-L |
||
| Propiedades físicas | ||
| Apariencia | cristales verde-azules o blancos : | |
| Densidad | 1898 kg/m³; 1898 g/cm³ | |
| Masa molar | 151,908 g/mol (sal anhidra); 169,923 g/mol (monohidrato); 224,120 g/mol (tetrahidrato); 242,135 g/mol (pentahidrato); 278,05 g/mol (heptahidrato) g/mol | |
| Punto de fusión | 337 K (64 °C) | |
| Punto de ebullición | 363 K (90 °C) | |
| Punto de descomposición | 573 K (300 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 29,5 g / 100mL de agua | |
| Termoquímica | ||
| ΔfH0sólido | -928,4 kJ/mol | |
| S0sólido | 107,5 J·mol–1·K–1 | |
| Peligrosidad | ||
| SGA |  |
|
| NFPA 704 |
1
2
1
|
|
| Frases R | 20/22-36/37/38 Nocivo por inhalación y por ingestión. Irrita los ojos, la piel y las vías respiratorias. | |
| Frases S | 2-7/8-24-26-36 Manténgase fuera del alcance de los niños. Manténgase el recipiente bien cerrado y en lugar seco. Evítese el contacto con la piel. En caso de contacto con los ojos, lávense inmediata y abundantemente con agua y acúdase a un médico. Úsese indumentaria protectora adecuada. | |
| Riesgos | ||
| Ingestión | Baja toxicidad en pequeñas cantidades pero dosis mayores pueden causar náuseas, vómitos y diarrea. La decoloración de la orina hacia un color rosado indica intoxicación con hierro lo que puede causar la muerte. | |
| Inhalación | Irritación en vías respiratorias | |
| Piel | Enrojecimiento | |
| Ojos | Causa irritación, dolor y enrojecimiento | |
| LD50 | oral ratón: 1520 mg/kg | |
| Compuestos relacionados | ||
| Otros aniones | Cloruro de hierro(II) sulfuro de hierro(II) sulfato amónico de hierro(II) óxido de hierro(II) |
|
| Otros cationes | sulfato de hierro(III) sulfato de cobre(II) sulfato de bario sulfato de amonio sulfato de plomo(II) |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
Contenido
Formas del Sulfato de Hierro(II)
El sulfato de hierro(II) puede presentarse con diferentes cantidades de agua en su estructura. A estas formas se les llama "hidratos". Algunas de estas formas se encuentran en la naturaleza como minerales:
- FeSO4·H2O (mineral: szomolnokita)
- FeSO4·4H2O
- FeSO4·5H2O (mineral: siderotilo)
- FeSO4·7H2O (mineral: melanterita)
Cuando el heptahidrato (la forma con siete moléculas de agua) se calienta a 90 °C, pierde la mayor parte de su agua. Se convierte en un monohidrato incoloro, que también se conoce como vitriolo verde o caparrosa.
La fórmula química FeSO4 se forma cuando el hidróxido ferroso (Fe(OH)2) reacciona con el ácido sulfúrico (H2SO4).
¿Cómo se obtiene el Sulfato de Hierro(II)?
Este compuesto se produce en grandes cantidades en la industria.
Producción en la Industria del Acero
Cuando se prepara el acero para recubrirlo o galvanizarlo, se sumerge en un baño de ácido sulfúrico. Este proceso genera mucho sulfato de hierro(II) como subproducto.
Producción de Dióxido de Titanio
Otra forma de obtener grandes cantidades de sulfato de hierro(II) es durante la fabricación de dióxido de titanio. Este se produce a partir de un mineral llamado ilmenita.
Métodos Comerciales
También se puede preparar el sulfato de hierro(II) oxidando la pirita. Otra forma es tratando el hierro directamente con ácido sulfúrico.
Propiedades Químicas del Sulfato de Hierro(II)
El sulfato de hierro(II) es un compuesto estable bajo condiciones normales.
- Cuando está en sus formas hidratadas, pierde agua si se expone al aire seco.
- Si se expone a la humedad, puede oxidarse y formar una capa marrón de sulfato de hierro(III). Esta capa es muy corrosiva.
- Al quemarse, puede liberar óxidos de azufre.
Usos del Sulfato de Hierro(II)
El sulfato ferroso tiene muchos usos importantes en diferentes áreas.
Tratamiento de Agua
Se utiliza para limpiar el agua, ayudando a que las partículas pequeñas se unan (proceso llamado coagulación). También sirve para eliminar fosfatos en las plantas de tratamiento de aguas. Esto ayuda a evitar que los cuerpos de agua, como lagos y ríos, se llenen demasiado de algas (un problema llamado eutrofización).
Agente Reductor
Grandes cantidades de esta sal se usan como agente reductor. Esto significa que ayuda a otras sustancias a ganar electrones. Es muy útil para reducir los cromatos en el cemento.
Beneficios para la Nutrición
El sulfato ferroso se usa para tratar la anemia ferropénica, una condición donde el cuerpo no tiene suficiente hierro. Esto puede causar cansancio y debilidad.
- Algunas personas pueden sentir náuseas o molestias en el estómago al tomarlo. Para evitarlo, se puede tomar antes de dormir o después de una comida.
- También se añade a algunos alimentos, como cereales, para enriquecerlos con hierro y mejorar la nutrición.
Uso como Colorante
El sulfato ferroso es un ingrediente importante en la fabricación de tintas.
- Se usó mucho en la tinta ferrogálica de hierro desde la Edad Media hasta la Revolución Americana.
- También se usa para teñir la lana como mordiente, lo que ayuda a que el color se fije mejor.
- En el siglo XVIII y siglo XIX, se usó para teñir telas con colorante índigo en un proceso llamado "azul de China".
- Puede usarse para darle al hormigón un color amarillento oxidado.
- Los carpinteros lo usan para teñir la madera de arce con un tono plateado.
Otros Usos Interesantes
- En horticultura, se usa para cuidar el césped y eliminar el musgo.
- En el siglo XIX, se empleó en la fotografía para revelar imágenes en el proceso de colodión húmedo.
- A veces se añade al agua de enfriamiento en los tubos de latón de los condensadores de turbinas. Esto ayuda a que los tubos resistan la erosión y protege su recubrimiento interno.
- En micología (el estudio de los hongos), se usa para identificar algunas setas. Por ejemplo, ayuda a distinguir la Russula cyanoxantha de otras russulas que sí reaccionan con el sulfato de hierro.
Galería de imágenes
Véase también
 En inglés: Iron(II) sulfate Facts for Kids
En inglés: Iron(II) sulfate Facts for Kids
- Sulfato de hierro(III), otro compuesto de hierro muy común.
- sulfato amónico de hierro(II), una sal doble que contiene sulfato de amonio y sulfato de hierro(II).
- Proceso del vitriolo, el primer método industrial para producir ácido sulfúrico.