Sulfato de hierro(III) para niños
Datos para niños
Sulfato de hierro(III) |
||
|---|---|---|
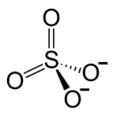
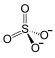 Fe3+ Fe3+  Fe3+ Fe3+  |
||
 |
||
| Nombre IUPAC | ||
| Tetraoxosulfato(VI) de hierro(III) | ||
| General | ||
| Otros nombres | Sulfato de hierro(III) Sulfato férrico Vitriolo de Marte Pálido Polvo sensible de humedad Hygroskopisches Geruclosas |
|
| Fórmula semidesarrollada | Fe(SO4)3 (forma anhidra) Fe(SO4)3·9H2O (nonahidrato) |
|
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 10028-22-5 (anhidro) 15244-10-7 (n-hidrato) n=9, 7, 6, 4, 3, 1 Ver CAS de cada hidrato en [1] |
|
| ChEBI | 53438 | |
| ChemSpider | 23211 | |
| PubChem | 24826 | |
| UNII | 4YKQ1X5E5Y | |
|
InChI
InChI=InChI=1S/2Fe.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6
Key: RUTXIHLAWFEWGM-UHFFFAOYSA-H |
||
| Propiedades físicas | ||
| Apariencia | Blanco cristalino | |
| Densidad | 1898 kg/m³; 1898 g/cm³ | |
| Masa molar | 399.87 (forma anhidra) g/mol | |
| Punto de fusión | 753 K (480 °C) | |
| Estructura cristalina | Rómbico | |
| Propiedades químicas | ||
| Solubilidad en agua | Soluble | |
| Termoquímica | ||
| ΔfH0sólido | -2583,0 kJ/mol | |
| S0sólido | 307,5 J·mol–1·K–1 | |
| Peligrosidad | ||
| Frases R | 22-36/37 | |
| Frases S | 26 | |
| Riesgos | Nocivo leve. Baja toxicidad en bajas cantidades. Grandes dosis pueden causar dolor abdominal, náuseas, vómitos y diarrea; decoloración urinaria. Dosis muy altas: daño al hígado, Posible coma. | |
| Inhalación | Irritaciones de las membranas mucosas y del tracto respiratorio. Tos. Dificultad respiratoria. | |
| Piel | Irritaciones. Enrojecimiento y dolor. | |
| Ojos | Irritaciones. Enrojecimiento y dolor. | |
| Compuestos relacionados | ||
| Otros aniones | Cloruro de hierro(III) Óxido de hierro(III) Bromuro de hierro(III) Nitrato de hierro(III) |
|
| Otros cationes | Sulfato de hierro(II) Sulfato de manganeso(III) Sulfato de cobalto(III) Sulfato de amonio |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El sulfato de hierro(III), también conocido como sulfato férrico, es un compuesto químico que contiene hierro, azufre y oxígeno. Es diferente del sulfato de hierro(II) porque el átomo de hierro tiene una carga eléctrica diferente, lo que lo hace un poco distinto.
Este compuesto es una sal sólida de color amarillo. Forma cristales con una estructura especial llamada sistema rómbico. Además, se disuelve fácilmente en agua a temperatura ambiente.
Sulfato de Hierro(III): Un Compuesto Químico Importante
¿Qué es el Sulfato de Hierro(III)?
El sulfato de hierro(III) es un tipo de sustancia química que se forma cuando el hierro se une con el sulfato. Es una sal, lo que significa que es un compuesto que se forma de un ácido y una base. Su nombre científico es Tetraoxosulfato(VI) de hierro(III).
Este compuesto se puede encontrar en varias formas, incluyendo una que no tiene agua (anhidra) y otras que sí la tienen (hidratadas), como el nonahidrato que tiene nueve moléculas de agua.
¿Para qué se Usa el Sulfato de Hierro(III)?
El sulfato de hierro(III) tiene muchos usos interesantes en diferentes industrias y campos.
Usos en la Industria
- Se utiliza como mordiente. Esto significa que ayuda a que los colorantes se fijen mejor en los tejidos o materiales.
- Funciona como coagulante en el tratamiento de residuos industriales. Ayuda a que las partículas pequeñas se agrupen y se asienten, facilitando su eliminación.
- También se usa como pigmento para dar color.
- Es útil en los baños de decapado, que son soluciones químicas para limpiar y preparar superficies de aluminio y acero.
Usos en la Medicina
- En medicina, se usa como astringente. Esto significa que ayuda a contraer los tejidos y puede detener pequeños sangrados.
- Es un ingrediente común en los lápices estípticos, que se usan para detener el sangrado de pequeños cortes, como los que ocurren al afeitarse.
¿Cómo se Obtiene el Sulfato de Hierro(III)?
La producción de sulfato de hierro(III) se realiza a gran escala para satisfacer sus diversas aplicaciones.
Producción a Gran Escala
Se fabrica combinando ácido sulfúrico con una solución caliente de sulfato ferroso. Para que la reacción funcione, se necesita un agente oxidante, como el ácido nítrico o el peróxido de hidrógeno.
Uso en el Tratamiento de Agua
En las plantas que tratan agua residual, el sulfato de hierro(III) es muy importante. Se usa como coagulante para ayudar a que las partículas sucias en el agua se unan y formen grupos más grandes. Estos grupos, llamados "micro-flocs", son de color naranja rojizo y se asientan en el fondo, haciendo que el agua sea más fácil de limpiar.
¿Es Seguro el Sulfato de Hierro(III)?
Como muchas sustancias químicas, el sulfato de hierro(III) debe manejarse con cuidado.
- Si se ingiere en grandes cantidades, puede causar malestar estomacal, como dolor, náuseas o diarrea.
- Si se inhala, puede irritar la nariz, la garganta y los pulmones, causando tos o dificultad para respirar.
- El contacto con la piel o los ojos puede causar irritación, enrojecimiento y una sensación de molestia.
Por estas razones, es importante usar equipo de protección adecuado cuando se trabaja con este compuesto.
Galería de imágenes
Véase también
 En inglés: Iron(III) sulfate Facts for Kids
En inglés: Iron(III) sulfate Facts for Kids