Butano para niños
El butano, también conocido como n-butano, es un hidrocarburo que se encuentra en estado gaseoso. Es inflamable y se vuelve líquido a una temperatura de -0,5 °C a presión normal. Está compuesto por cuatro átomos de carbono y diez de hidrógeno, y su fórmula química es C4H10. Existe otro tipo de butano llamado isobutano o metilpropano, que tiene la misma fórmula pero una estructura diferente.
El butano comercial es un gas licuado que se obtiene del petróleo. Está formado principalmente por butano normal (60%), propano (9%), isobutano (30%) y etano (1%).
Como el butano puro no tiene color ni olor, se le añade una sustancia especial (generalmente un mercaptano) que le da un olor desagradable. Esto es muy importante para que podamos detectar si hay una fuga de gas, ya que el butano es muy ligero y puede acumularse en un lugar cerrado, lo que podría causar una explosión.
Para apagar un fuego de butano, se pueden usar dióxido de carbono (CO2), polvo químico o niebla de agua.
Datos para niños
Butano |
||
|---|---|---|
 |
||
| Nombre IUPAC | ||
| Butano | ||
| General | ||
| Fórmula semidesarrollada | CH3CH2CH2CH3 | |
| Fórmula estructural | ||
| Fórmula molecular | C4H10 | |
| Identificadores | ||
| Número CAS | 106-97-8 | |
| Número RTECS | EJ4200000 | |
| ChEBI | 37808 | |
| ChEMBL | CHEMBL134702 | |
| ChemSpider | 7555 | |
| PubChem | 7843 | |
| UNII | 6LV4FOR43R | |
| KEGG | D03186 | |
|
InChI
InChI=InChI=1S/C4H10/c1-3-4-2/h3-4H2,1-2H3
Key: IJDNQMDRQITEOD-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 2,52 kg/m³; 0,00252 g/cm³ | |
| Masa molar | 58,08 g/mol | |
| Punto de fusión | 134,9 K (−138 °C) | |
| Punto de ebullición | 272,7 K (0 °C) | |
| Temperatura crítica | 425 K (152 °C) | |
| Viscosidad | 0,0074 cP (20 °C) | |
| Índice de refracción (nD) | 1,3326 (20 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 6,1 mg/100 mL H2O | |
| Termoquímica | ||
| ΔfH0gas | -124,9 kJ/mol | |
| S0líquido, 1 bar | 231,0 J·mol–1·K–1 | |
| Peligrosidad | ||
| SGA |  |
|
| Punto de inflamabilidad | 213 K (−60 °C) | |
| NFPA 704 |
4
1
0
|
|
| Temperatura de autoignición | 638 K (365 °C) | |
| Frases R | R12 | |
| Frases S | S2, S9, S16 | |
| Límites de explosividad | 1,8%-8.4% | |
| Riesgos | ||
| Inhalación | Somnolencia. Pérdida del conocimiento. Sensación de Bienestar. Alucinaciones. | |
| Piel | En contacto con líquido: congelación. | |
| Ojos | En contacto con líquido: congelación y sobre evaporación | |
| Compuestos relacionados | ||
| Alcanos | Propano, Pentano, Metilpropano | |
| Otros | 1-clorobutano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
Contenido
Fugas de gas: ¿Por qué son peligrosas?
Los escapes de un gas inflamable, como el butano, son muy peligrosos. Si el gas se escapa y entra en contacto con una llama o una chispa, puede causar una explosión. Por eso es tan importante que el butano tenga un olor fuerte para que podamos darnos cuenta de una fuga a tiempo.
Historia del Butano
¿Quién descubrió el butano?
El butano fue descubierto por accidente en 1849 por un químico británico llamado Edward Frankland. Él estaba trabajando con otras sustancias y sin querer creó el butano, aunque al principio no se dio cuenta de lo que había encontrado.
¿Cómo se llamó el butano al principio?
Al principio, Frankland llamó al butano "hidruro de butilo". Con el tiempo, se le dieron otros nombres como "hidruro de tetril" o "dietil". El nombre moderno "butano" se empezó a usar en inglés alrededor de 1874, tomado del alemán.
¿Cuándo se empezó a usar el butano?
El butano no se usó mucho hasta la década de 1910. Fue entonces cuando W. Snelling descubrió que el butano y el propano, que se encontraban en la gasolina, podían guardarse en estado líquido en recipientes a presión si se enfriaban. Esto hizo que fuera más fácil transportarlos y usarlos.
Densidad del Butano
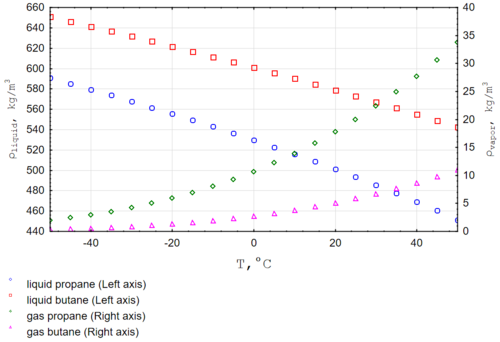
La densidad de un gas nos dice cuánto pesa en un espacio determinado. La densidad del butano cambia mucho según la temperatura y la presión. Por ejemplo, el butano líquido es más denso que el propano líquido. A una temperatura de -13 °C, la densidad del butano líquido es de aproximadamente 625,5 kilogramos por metro cúbico.
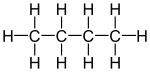
Tipos de Butano: Isómeros
El butano tiene dos formas principales, llamadas isómeros, que tienen la misma fórmula química (C4H10) pero una estructura diferente.
| Nombre común | butano normal butano no ramificado n-butano |
isobutano i-butano |
| nombre IUPAC | butano | metilpropano |
| diagrama molecular |
 |
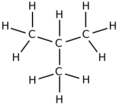 |
| Dagrama esquelético |
 |
El butano normal puede tener diferentes formas en el espacio debido a la forma en que sus átomos giran alrededor de los enlaces.
Reacciones del Butano
Cuando el butano se quema con suficiente oxígeno, produce dióxido de carbono y vapor de agua. Si no hay suficiente oxígeno, también puede producir carbono (como el hollín) o monóxido de carbono, que es un gas peligroso. El butano es más pesado que el aire.
- Cuando hay suficiente oxígeno:
2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
- Cuando la cantidad de oxígeno es limitada:
2 C4H10 + 9 O2 → 8 CO + 10 H2O
El butano tiene mucha energía. Por cada kilogramo de butano, se pueden obtener aproximadamente 49.5 megajulios de energía.
Usos del Butano
El butano normal se usa de varias maneras:
- Se mezcla con la gasolina para que los motores arranquen mejor, especialmente en invierno.
- Se usa como gas combustible para cocinar o calentar.
- Sirve como disolvente para extraer fragancias.
- Es una materia prima para fabricar etileno y butadieno, que son importantes para el caucho sintético.
El isobutano se usa principalmente en las refinerías para mejorar la calidad de la gasolina de los coches, aumentando su octanaje.
Butano en el hogar y la industria
Cuando el butano se mezcla con propano y otros hidrocarburos, se le llama comercialmente gas licuado de petróleo (GLP). Se usa en la gasolina, como material para producir otros productos químicos en la industria, como combustible para encendedores y como gas para que funcionen los aerosoles, como los desodorantes.
Las formas puras de butano, especialmente el isobutano, se usan como refrigerantes en frigoríficos, congeladores y sistemas de aire acondicionado. Han reemplazado a otros gases que dañaban la capa de ozono.
El butano también es el combustible de los encendedores comunes o de los soplete de butano. Se vende en botellas como combustible para cocinar, hacer barbacoas y usar en estufas de camping.
Como combustible, se le añaden pequeñas cantidades de sustancias con olor fuerte, como los mercaptanos. Así, si hay una fuga de gas, podemos olerla fácilmente.
Aplicaciones del Butano
La principal aplicación del gas butano (C4H10) es como combustible en las casas para cocinar, calentar agua, en estufas y en los encendedores de gas de bolsillo.
El butano en España
En España, el gas butano se transporta en las conocidas bombonas o garrafas de butano. Son recipientes cilíndricos de acero, normalmente de color naranja, que contienen 12,5 kg de butano. La mayor parte del butano dentro de la bombona está en estado líquido, a presión. También existen bombonas más ligeras hechas de acero inoxidable.
Es muy importante revisar la instalación de gas en casa cada cinco años. Esto lo debe hacer una empresa especializada para asegurar que todo funciona correctamente y evitar accidentes.
Propiedades Físicas y Químicas del Butano
- Color: Es incoloro, es decir, no tiene color.
- Olor: Cuando es puro, no huele a nada. Por eso se le añade una sustancia (como el metil mercaptano) que le da un olor característico para detectar fugas.
- Densidad relativa de vapor (aire=1): 2.1. Esto significa que es más pesado que el aire.
- Densidad en estado líquido (a 16 °C): 0,582 gramos por centímetro cúbico.
- Solubilidad en agua: Se disuelve muy poco en agua, solo 3.25 mililitros en 100 mililitros de agua a 20 °C.
- Punto de ebullición: -1 °C. A esta temperatura, el butano líquido se convierte en gas.
- Punto de fusión: -138 °C. A esta temperatura, el butano se congela.
- Masa molar: 58 gramos por mol.
- Poder calorífico superior: Aproximadamente 49 608 kilojulios por kilogramo. Esto indica la cantidad de energía que libera al quemarse.
Efectos del Butano en la Salud
El butano no es una sustancia tóxica en sí misma. Sin embargo, como es más pesado que el aire, si se acumula en un lugar cerrado, puede desplazar el oxígeno. Esto significa que no habría suficiente oxígeno para respirar, lo que podría causar asfixia.
Si el butano líquido entra en contacto con la piel o los ojos, puede causar congelación debido a su baja temperatura.
Cuando el butano se quema, puede producir una pequeña cantidad de dióxido de nitrógeno, un gas que puede ser perjudicial para la salud si se inhala en grandes cantidades. Por eso es importante que los calentadores y estufas de butano se usen en lugares con buena ventilación.
|
Véase también
 En inglés: Butane Facts for Kids
En inglés: Butane Facts for Kids
- Alcano
- Gas natural
- Petróleo
- Gas licuado del petróleo
- Butilo
- Bombona de butano