Cianuro de hidrógeno para niños
Datos para niños
Cianuro de hidrógeno |
||
|---|---|---|
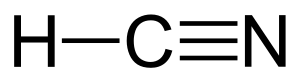 Estructura molecular
|
||
 Estructura tridimensional
|
||
| Nombre IUPAC | ||
| Cianuro de hidrógeno | ||
| General | ||
| Otros nombres | Ácido cianhídrico Ácido prúsico Metanonitrilo Ácido azul Ciclón Cianano Anni metacolina Formonitrilo |
|
| Fórmula semidesarrollada | HCN | |
| Fórmula estructural | ||
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 74-90-8 | |
| Número RTECS | MW6825000 | |
| ChEBI | 18407 | |
| ChEMBL | CHEMBL183419 | |
| ChemSpider | 19951400 748, 19951400 | |
| PubChem | 768 | |
| UNII | 2WTB3V159F | |
| KEGG | C01326 | |
|
InChI
InChI=InChI=1S/CHN/c1-2/h1H
Key: LELOWRISYMNNSU-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Masa molar | 27,011 g/mol | |
| Índice de refracción (nD) | 1,2675 | |
| Propiedades químicas | ||
| Acidez | 9,21 pKa | |
| Termoquímica | ||
| ΔfH0gas | 135.14 kJ/mol | |
| ΔfH0líquido | 109 kJ/mol | |
| ΔfH0sólido | 100 kJ/mol | |
| S0gas, 1 bar | 201.82 J·mol–1·K | |
| S0líquido, 1 bar | 113.01 J·mol–1·K–1 | |
| Peligrosidad | ||
| SGA |      |
|
| NFPA 704 |
4
4
2
|
|
| Frases H | H225, H300, H310, H319, H330, H336, H370, H410 | |
| Frases P | P210, P261, P305+P351+P338 | |
| Riesgos | ||
| Ingestión | Extremadamente tóxico. Síntomas tempranos: náusea, vómitos y dolor abdominal. | |
| Inhalación | Extremadamente peligroso. | |
| Piel | Se cree que es posible el envenenamiento a través de la piel. | |
| Ojos | Las pupilas dilatadas son un síntoma de envenenamiento. | |
| Más información | Hazardous Chemical Database | |
El cianuro de hidrógeno [H-C≡N(g)] o ácido cianhídrico [H-C≡N(ac)], ácido prúsico, metanonitrilo o formonitrilo es un compuesto químico cuya fórmula es: HCN. La disolución de cianuro de hidrógeno en agua es llamada ácido cianhídrico. El cianuro de hidrógeno puro es un líquido incoloro, muy venenoso y altamente volátil, que hierve a 26 °C. Tiene un ligero olor a almendras amargas, que algunas personas no pueden detectar debido a un rasgo genético recesivo. El cianuro de hidrógeno es ligeramente ácido. Sus sales son conocidas como cianuros.
Contenido
Historia del descubrimiento
El ácido cianhídrico fue aislado por primera vez desde el tinte azul (azul de Prusia). Este tinte se conocía ya desde 1704 pero su estructura molecular era completamente desconocida. En la actualidad es conocido como un polímero de coordinación con una estructura compleja y una fórmula empírica procedente de la hidratación del ferrocianuro. En 1752, el químico francés Pierre Macquer dio un importante paso al mostrar que el azul de Prusia podría convertirse en un óxido de hierro más un compuesto volátil que podría ser empleado como reconstituyente del colorante. El nuevo componente fue conocido como cianuro de hidrógeno. Los siguientes descubrimientos tras Macquer, fueron el aislamiento y la caracterización del ácido cianhídrico en su forma más pura desde el azul de prusia en 1783 por el químico sueco Carl Wilhelm Scheele, y durante esa época se le dio de forma eventual el nombre alemán: Blausäure (literalmente ‘ácido azul’) debido a su naturaleza ácida en el agua y su derivación del azul de Prusia. En inglés se hizo conocido popularmente como ácido prúsico.
En 1787 el químico francés Claude Louis Berthollet demostró que el ácido prúsico no contenía oxígeno, siendo esta una importante contribución a la teoría del ácido, que hasta entonces promulgaba que los ácidos debían contener oxígeno. (de hecho, la palabra oxígeno deriva del griego clásico y significa «el formador de ácidos», y se emplea en idiomas como el alemán como un calco semántico como: Sauerstoff). En 1815 Joseph Louis Gay-Lussac dedujo la fórmula química del ácido. El radical cianídrico recibe su nombre de «cyan», que proviene del griego clásico y que significa azul, debido a su origen del azul de Prusia.
Producción y síntesis
El cianuro de hidrógeno se produce en grandes cantidades en todo el mundo por la industria química. Se usa en tintes, explosivos, producción de plásticos, etc. Puede producirse mediante la reacción entre un cianuro y un ácido fuerte, o directamente de amoníaco y monóxido de carbono.
Las frutas que tienen una semilla grande, como el cantalupo, el níspero o el albaricoque, generalmente tienen pequeñas cantidades de cianuro de hidrógeno en su semilla. Las almendras amargas, de las que se extrae el aceite de almendra, también lo contienen. Algunos milpiés lo usan como medio de defensa, así como otros insectos. También se lo puede encontrar en los gases producidos por motores de vehículos, en el humo del tabaco y en el humo de la combustión de plásticos que contienen nitrógeno.
El proceso más importante es el Proceso de Andrussow, inventada por Leonid Andrussow en IG Farben en la que el metano y el amoníaco reaccionan en la presencia de oxígeno alrededor de 1200 °C sobre un catalizador de platino:
- <chem>2CH4 + 2NH3 + 3O2 -> 2HCN + 6H2O</chem>
La energía necesaria para la reacción es proporcionada por la oxidación parcial de metano y amoniaco.
De menor importancia es el proceso Degussa (proceso BMA) en el que no se agrega oxígeno y la energía deben ser transferidos indirectamente a través de la pared del reactor:
- <chem>CH4 + NH3 -> HCN + 3H2</chem>
Esta reacción es similar a la de reformado con vapor, en la que reacciona metano con agua para dar monóxido de carbono e hidrógeno.
En el proceso de Shawinigan, el amoniaco y el gas natural trasladan más de coque. Tal como se practica en BASF, la formamida es calentada y se divide en cianuro de hidrógeno y agua:
- <chem>CH(O)NH2 -> HCN + H2O</chem>
En el laboratorio, se producen pequeñas cantidades de HCN añadiendo ácidos sobre sales de cianuro de metales alcalinos:
- <chem>H^+ + NaCN -> HCN + Na^+</chem>
Esta reacción puede producir envenenamientos accidentales porque el ácido convierte la sal de cianuro en HCN gaseoso.
Métodos históricos de producción
La demanda de cianuros para las operaciones mineras en la década de 1890 fue recibido por George Thomas Beilby, que patentó un método para producir cianuro de hidrógeno al pasar amoníaco sobre carbón incandescente en 1892. Este método se utilizó hasta 1894, en que Hamilton Castner desarrolló su síntesis a partir de carbón, amoniaco y sodio produciendo cianuro de sodio, que reacciona con ácido para formar HCN gaseoso.
Aplicaciones
El HCN es el precursor del cianuro de sodio y el cianuro de potasio, que se utilizan principalmente en la minería. A través de la intermediación de las cianohidrinas, se preparan una variedad de compuestos orgánicos útiles a partir de HCN incluyendo el monómero metacrilato de metilo, de la acetona, el aminoácido metionina, a través de la síntesis de Strecker, y los agentes quelantes EDTA y NTA. A través del proceso de la hidrocianación, el HCN se agrega al butadieno para dar adiponitrilo, un precursor del Nylon 66.
Salud
Una concentración de 300 partes por millón en el aire es suficiente para acabar con la vida humana en cuestión de minutos. Su toxicidad se debe al ion cianuro CN-, que inhibe la respiración celular. Su capacidad de envenenamiento es superior a la del CO en los incendios y paraliza a una víctima en un breve periodo de tiempo; este efecto debe ser tenido en cuenta por los bomberos. Suele producirse por la combustión de productos sintéticos tales como ropas, moquetas, alfombras, etc.
Su ingesta suele ser debida al consumo de una variedad de yuca (Manihot esculenta) que contiene una concentración más alta de HCN, conocida en algunos países como «yuca amarga», semillas de melón (cantalupo) y almendra amarga. Se sabe también de la existencia de plantas cianogénicas, las cuales han sido responsables en muchos casos de cianosis crónica en animales y humanos. El ácido cianhídrico es un inhibidor de varias metaloenzimas, como la citocromo oxidasa, la cual es una enzima terminal de la respiración celular en el primer paso de acción, provocando así una anoxia celular.
Véase también
 En inglés: Hydrogen cyanide Facts for Kids
En inglés: Hydrogen cyanide Facts for Kids
- Cianuro
- Intoxicación cianhídrica
- Glucósido cianogénico


