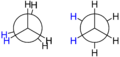Alcano para niños
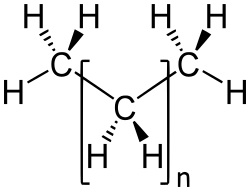
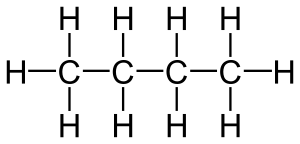
Los alcanos son un tipo de hidrocarburos, lo que significa que están hechos solo de átomos de carbono e hidrógeno. Son como los "ladrillos" más simples en el mundo de la química orgánica. Su fórmula general para los que tienen una cadena recta es CnH2n+2, donde "n" es el número de átomos de carbono.
También se les llama hidrocarburos saturados porque todos sus enlaces entre átomos son simples. Esto significa que cada átomo de carbono está unido a la mayor cantidad posible de átomos de hidrógeno, sin dejar espacio para más enlaces. Son bastante estables y no reaccionan fácilmente con otras sustancias.
Contenido
¿Qué son los alcanos de cadena abierta?
Los alcanos de cadena abierta pueden ser como una cadena recta o tener "ramas". Su fórmula siempre es CnH2n+2. Son muy poco reactivos en comparación con otros compuestos orgánicos. Todos los enlaces en los alcanos son sencillos, lo que significa que los átomos comparten un par de electrones de forma equitativa.
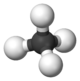
El alcano más simple es el metano, que tiene solo un átomo de carbono. Otros alcanos comunes son el etano, el propano y el butano, con dos, tres y cuatro átomos de carbono, respectivamente. A partir de cinco carbonos, sus nombres se basan en el número de átomos de carbono que tienen.
| C | Nombre | Fórmula | Modelo |
|---|---|---|---|
| 1 | Metano | CH4 | |
| 2 | Etano | C2H6 | |
| 3 | Propano | C3H8 | |
| 4 | Butano | C4H10 | |
| 5 | Pentano | C5H12 | |
| 6 | Hexano | C6H14 | |
| 7 | Heptano | C7H16 | |
| 8 | Octano | C8H18 | |
| 9 | Nonano | C9H20 | |
| 10 | Decano | C10H22 | |
| 11 | Undecano | C11H24 | |
| 12 | Dodecano | C12H26 |
¿Qué son los cicloalcanos?
Los cicloalcanos son hidrocarburos que forman un anillo o ciclo. Su fórmula es CnH2n. Sus propiedades físicas son parecidas a las de los alcanos de cadena abierta, pero sus propiedades químicas pueden ser un poco diferentes, especialmente los que tienen anillos más pequeños.
¿Dónde se encuentran los alcanos?
Alcanos en el universo
Los alcanos son una parte importante de la atmósfera de los planetas gigantes, como Júpiter, Saturno, Urano y Neptuno. El metano es el más común.
Titán, una luna de Saturno, tiene una atmósfera donde llueve metano líquido. También se cree que hay lagos de metano y etano cerca de sus polos. Incluso se ha detectado metano y etano en la cola de algunos cometas.
Alcanos en la Tierra
En la atmósfera de la Tierra hay pequeñas cantidades de gas metano. Este gas es producido principalmente por organismos diminutos llamados Archaea, que viven, por ejemplo, en el estómago de las vacas.
La fuente más importante de alcanos para nosotros es el gas natural y el petróleo. El gas natural es principalmente metano y etano. El petróleo es una mezcla de alcanos líquidos y otros hidrocarburos. Estos se formaron a lo largo de millones de años a partir de plantas y animales marinos muertos que quedaron enterrados bajo sedimentos.
Los alcanos sólidos se conocen como alquitrán. Se forman cuando los alcanos más ligeros se evaporan de los depósitos de hidrocarburos. Un gran depósito de alquitrán se encuentra en el lago Pitch en Trinidad y Tobago.
El metano también se encuentra en el biogás, que se produce por la descomposición de materia orgánica y es una posible fuente renovable de energía.
Alcanos en los seres vivos
Aunque los alcanos no son considerados esenciales para la vida, se encuentran en la naturaleza de diferentes formas.
- Bacterias y Archaea: Algunas bacterias pueden usar alcanos como alimento. Ciertas archaea, llamadas metanógenos, producen mucho metano como parte de su metabolismo. Son responsables del "gas de los pantanos" en los humedales y del metano que liberan el ganado y las termitas.
- Hongos y plantas: Algunos hongos pueden usar alcanos como fuente de energía. En las plantas, los alcanos de cadena larga forman una capa de cera llamada cutícula sobre las partes expuestas al aire. Esta capa protege a la planta de perder agua y de ser atacada por bacterias, hongos e insectos. La capa brillante de las manzanas, por ejemplo, está hecha de alcanos.
- Animales: Los alcanos se encuentran en productos animales, como el aceite de hígado de tiburón. También son importantes en las feromonas, que son sustancias químicas que los insectos usan para comunicarse. Por ejemplo, algunas abejas usan alcanos en sus feromonas para encontrar pareja.

Relaciones en la naturaleza
Un ejemplo interesante de cómo los alcanos de plantas y animales se relacionan es la orquídea Ophrys sphegodes y la abeja Andrena nigroaenea. Las abejas macho son atraídas por el olor de las feromonas de las hembras, que contienen una mezcla de alcanos. La orquídea imita este olor y la apariencia de la abeja hembra para atraer a los machos. Cuando los machos intentan aparearse con la flor, recogen polen y lo llevan a otras orquídeas, ayudando a la planta a reproducirse.
¿Cómo se obtienen los alcanos?
Refinado del petróleo
La forma más común de obtener alcanos es del gas natural y el petróleo crudo. En una refinería de petróleo, los alcanos se separan usando un proceso llamado destilación fraccionada, que los divide en diferentes productos según su tamaño.
Producción en laboratorio
Generalmente, no es necesario fabricar alcanos en un laboratorio porque ya están disponibles comercialmente. Además, no son muy reactivos. Sin embargo, a veces se pueden obtener como parte de otras reacciones químicas. Por ejemplo, se pueden preparar a partir de otras sustancias como los alquenos o alquinos mediante un proceso llamado hidrogenación.
¿Qué propiedades tienen los alcanos?
Punto de ebullición
El punto de ebullición de los alcanos aumenta a medida que la molécula se hace más grande y tiene más átomos de carbono. Esto se debe a que las fuerzas que mantienen unidas a las moléculas son mayores.
- Los alcanos con 1 a 4 carbonos son gases a temperatura ambiente (como el metano y el butano).
- Los que tienen de 5 a 17 carbonos son líquidos (como la gasolina).
- Los que tienen 18 o más carbonos son sólidos (como la cera de parafina).
Los alcanos de cadena recta tienen puntos de ebullición más altos que los de cadena ramificada con el mismo número de carbonos. Esto es porque las moléculas de cadena recta pueden "encajar" mejor entre sí, lo que hace que las fuerzas de unión sean más fuertes.
Punto de fusión
El punto de fusión de los alcanos también aumenta con el tamaño de la molécula. Sin embargo, hay una curiosidad: los alcanos con un número impar de carbonos tienen puntos de fusión ligeramente más bajos de lo esperado. Esto se debe a que los alcanos con un número par de carbonos se organizan mejor en su estado sólido, lo que requiere más energía para derretirlos.
Conductividad
Los alcanos no conducen bien la electricidad y no se ven afectados significativamente por un campo eléctrico.
Solubilidad
Los alcanos no se mezclan bien con el agua porque no forman puentes de hidrógeno. Se dice que son hidrofóbicos (repelen el agua). Por eso, si mezclas aceite (que contiene alcanos) con agua, el aceite flotará encima. Sin embargo, se disuelven bien en otros líquidos no polares.
Densidad
La densidad de los alcanos generalmente aumenta con el número de átomos de carbono, pero siempre es menor que la del agua. Por eso, los alcanos siempre flotan sobre el agua.
Forma de las moléculas
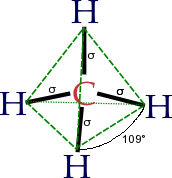
La forma de las moléculas de los alcanos es muy importante para sus propiedades. Los átomos de carbono en los alcanos siempre tienen una forma tetraédrica, lo que significa que los enlaces se extienden en el espacio como las esquinas de una pirámide de tres lados, con ángulos de aproximadamente 109.5 grados entre ellos.
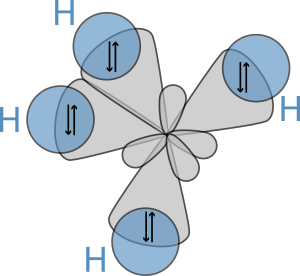
Las moléculas de alcanos no tienen una forma fija, sino que pueden girar alrededor de sus enlaces carbono-carbono. Esto significa que pueden adoptar diferentes "conformaciones" o formas en el espacio. Por ejemplo, el etano puede tener una forma "eclipsada" o una forma "alternada", siendo esta última más estable.
| NOMBRE | Fórmula | Pto.Ebu/oC | Pto. Fus./oC | Densidad g/cm -3(20.oC) |
| Metano | CH4 | -162 | -183 | gas |
| Etano | C2H6 | -89 | -172 | gas |
| Propano | C3H8 | -42 | -188 | gas |
| Butano | C4H10 | -0.5 | -135 | gas |
| Pentano | C5H12 | 36 | -130 | 0.626 |
| Hexano | C6H14 | 69 | -95 | 0.659 |
| Heptano | C7H16 | 98 | -91 | 0.684 |
| Octano | C8H18 | 126 | -57 | 0.703 |
| Nonano | C9H20 | 151 | -54 | 0.718 |
| Decano | C10H22 | 174 | -30 | 0.730 |
| Undecano | C11H24 | 196 | -26 | 0.740 |
| Dodecano | C12H26 | 216 | -10 | 0.749 |
| Icosano | C20H42 | 343 | 37 | sólido |
¿Cómo reaccionan los alcanos?
Los alcanos son poco reactivos porque sus enlaces son muy estables. Por eso se les llama "parafinas", que significa "con poca afinidad" (a reaccionar). En el petróleo, las moléculas de alcanos pueden permanecer sin cambios químicos durante millones de años.
Sin embargo, pueden reaccionar con oxígeno (combustión) y con halógenos (sustitución).
Reacciones con oxígeno (combustión)
Todos los alcanos pueden quemarse en presencia de oxígeno, aunque se vuelven más difíciles de encender a medida que son más grandes. Cuando se queman completamente, producen dióxido de carbono (CO2) y agua (H2O). Si no hay suficiente oxígeno, pueden producir monóxido de carbono (CO) o incluso negro de humo.
Por ejemplo, el metano se quema así:
- CH4 + 2O2 → CO2 + 2H2O
Reacciones con halógenos
Los alcanos reaccionan con halógenos (como el cloro o el bromo) en una reacción llamada "halogenación radicalaria". En esta reacción, los átomos de hidrógeno del alcano son reemplazados por átomos de halógeno. Esta reacción puede ser muy fuerte y a veces explosiva.
Cracking
El "cracking" es un proceso que rompe moléculas grandes de alcanos en moléculas más pequeñas. Esto se hace calentándolos o usando un catalizador. Es importante en la industria para obtener alcanos más pequeños y útiles.
Isomerización y reformado
En la isomerización, los alcanos de cadena recta se convierten en sus "isómeros" de cadena ramificada (moléculas con la misma fórmula pero diferente estructura). En el reformado, los alcanos se convierten en formas cíclicas o aromáticas, liberando hidrógeno. Estos procesos mejoran la calidad de los combustibles.
¿Para qué se usan los alcanos?
Las aplicaciones de los alcanos dependen de su tamaño:
- Alcanos pequeños (1 a 4 carbonos): Se usan principalmente para calentar y cocinar. El metano y el etano son los componentes principales del gas natural. El propano y el butano son los gases licuados del petróleo (GLP), usados en estufas, calentadores y encendedores. También se usan como propelentes en aerosoles.
- Alcanos medianos (5 a 17 carbonos): Son líquidos volátiles. Se usan como combustibles en motores de coches, ya que se evaporan rápidamente. Los alcanos ramificados son mejores para los motores porque evitan el "cascabeleo". También son buenos solventes para sustancias no polares.
- Alcanos grandes (18 o más carbonos): Son componentes importantes del aceite combustible y los aceites lubricantes. Los lubricantes también protegen contra la corrosión. Muchos alcanos sólidos se usan como cera de parafina, por ejemplo, en las velas.
- Alcanos muy grandes (35 o más carbonos): Se encuentran en el betún, que se usa para asfaltar caminos.
- Polímeros: Algunos polímeros sintéticos, como el polietileno y el polipropileno, son alcanos con cadenas muy largas. Estos materiales se usan en muchísimas cosas, desde envases hasta tuberías.
¿Qué riesgos tienen los alcanos?
El metano puede ser explosivo si se mezcla con aire en ciertas proporciones. También es un gas que contribuye al efecto invernadero. Otros alcanos pequeños también pueden formar mezclas explosivas con el aire.
Los alcanos líquidos ligeros son muy inflamables. Este riesgo disminuye a medida que la cadena de carbono se hace más larga. Algunos alcanos, como el hexano de cadena lineal, pueden ser perjudiciales para la salud si se exponen a ellos.
Galería de imágenes
-
Modelo de barras y esferas de los dos rotámeros del etano.
Véase también
 En inglés: Alkane Facts for Kids
En inglés: Alkane Facts for Kids