Cicloalcano para niños
Los cicloalcanos son un tipo especial de hidrocarburos. Imagina que los átomos de carbono se unen entre sí formando un círculo o anillo, como si se dieran la mano para formar una cadena cerrada. Además, todos los enlaces entre los átomos de carbono son simples, lo que significa que están "saturados" con átomos de hidrógeno.
Su fórmula general es CnH2n, donde "n" es el número de átomos de carbono. Esto significa que por cada átomo de carbono, hay el doble de átomos de hidrógeno. Curiosamente, tienen la misma fórmula que los alquenos, pero su estructura es diferente.
También existen compuestos con varios anillos, llamados compuestos policíclicos. A veces, estos anillos pueden tener "ramas" o cadenas lineales unidas a ellos.
Contenido
Nomenclatura: ¿Cómo se nombran?
Nombrar los cicloalcanos es bastante sencillo. Se usa el mismo nombre que para los hidrocarburos de cadena abierta con el mismo número de carbonos, pero se añade el prefijo ciclo- al principio.
Por ejemplo:
| Ciclopropano | 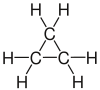 |
|
|---|---|---|
| Ciclobutano | 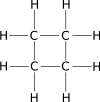 |
Cuando un cicloalcano tiene cadenas laterales (ramas), se nombran primero las ramas y luego el anillo. Se asigna un número a cada carbono del anillo para indicar dónde están las ramas. Se busca la combinación de números más baja posible para las posiciones de las ramas.
Propiedades físicas: ¿Cómo son?
Los cicloalcanos suelen tener puntos de fusión y ebullición más altos que los alcanos de cadena abierta con el mismo número de carbonos. Esto se debe a que sus estructuras en forma de anillo pueden empaquetarse de forma más compacta. También son un poco más densos.
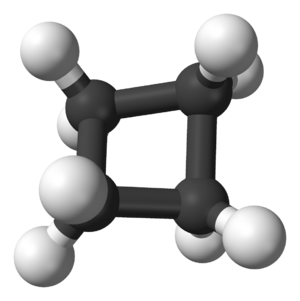
Una característica importante de los cicloalcanos es la "tensión del anillo". Esto ocurre cuando los ángulos entre los enlaces de los átomos de carbono en el anillo se desvían de su ángulo ideal (que es de unos 109°). Si los ángulos son muy diferentes, el anillo es más inestable. Por ejemplo, el ciclopropano es muy inestable porque sus ángulos son de solo 60°.
Propiedades químicas: ¿Cómo reaccionan?
La mayoría de los cicloalcanos, especialmente los que tienen anillos más grandes (como el ciclopentano o el ciclohexano), reaccionan de forma muy parecida a los alcanos de cadena abierta. Sin embargo, los anillos muy pequeños, como el ciclopropano y el ciclobutano, son más reactivos debido a la tensión que tienen en sus enlaces.
Presencia en la naturaleza
Los cicloalcanos se encuentran de forma natural en algunos tipos de petróleo. También forman parte de muchas sustancias importantes en la naturaleza, como los terpenos, que son compuestos presentes en plantas y animales.
Algunos cicloalcanos con anillos más grandes (de 14 a 18 átomos de carbono) se encuentran en las secreciones de las glándulas del almizcle, que se usa en perfumería.
Algunos cicloalcanos importantes
Ciclopropano
El ciclopropano es el cicloalcano más simple, con solo tres átomos de carbono formando un triángulo. Es una sustancia muy inestable y reactiva. Sus enlaces están muy "apretados" porque los ángulos son de 60°, muy lejos de los 109° ideales. Por eso, reacciona fácilmente abriendo su anillo.
Ciclobutano
El ciclobutano tiene cuatro átomos de carbono en un anillo. Sus ángulos de enlace son de unos 88°, lo que también genera tensión, aunque menos que en el ciclopropano. Su forma no es completamente plana, sino ligeramente plegada.
Ciclopentano
El ciclopentano está formado por cinco átomos de carbono. Sus ángulos de enlace son de unos 108°, muy cercanos al ángulo ideal. Por esta razón, tiene muy poca tensión en el anillo y es bastante estable. Su molécula no es plana, sino que se pliega un poco, como un sobre, para evitar que los átomos de hidrógeno se estorben entre sí.
Ciclohexano
El ciclohexano es uno de los cicloalcanos más importantes, con seis átomos de carbono. No es plano, sino que puede adoptar diferentes formas, como la "silla" o el "bote". La forma de "silla" es la más estable porque permite que todos los ángulos de enlace sean de 109.5°, sin ninguna tensión.
Aplicaciones: ¿Para qué se usan?
Los cicloalcanos tienen varias aplicaciones:
- El ciclohexano es un componente de la gasolina y se usa para fabricar poliamidas, que son materiales plásticos.
- El ciclopropano es un gas que se ha usado como anestésico.
- El ciclopentano y el ciclohexano se encuentran en ciertos tipos de petróleo y se usan como disolventes.
Efectos en la salud
En general, los cicloalcanos tienen efectos en la salud similares a los de los alcanos (hidrocarburos de cadena abierta). Por ejemplo, el ciclohexano es menos perjudicial que el hexano.
Véase también
 En inglés: Cycloalkane Facts for Kids
En inglés: Cycloalkane Facts for Kids
- Cicloalqueno