Óxido de cobre(II) para niños
El óxido de cobre(II), también conocido como óxido cúprico (<chem>CuO</chem>), es un compuesto químico que se forma cuando el cobre se une con el oxígeno. Es el óxido de cobre más común y se encuentra en la naturaleza como un mineral llamado tenorita. Este compuesto es de color negro o pardo oscuro y tiene muchas aplicaciones importantes en la industria y la vida diaria.
Datos para niños
Óxido de cobre(II) |
||
|---|---|---|
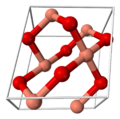
 Celda unidad del óxido de cobre(II) no es un metal
|
||
 |
||
| Nombre IUPAC | ||
| Oxido de cobre(II) | ||
| General | ||
| Otros nombres | Óxido cúprico | |
| Fórmula semidesarrollada | CuO | |
| Fórmula estructural | CuO | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 1317-38-0 | |
| Número RTECS | GL7900000 | |
| ChEMBL | 1909057 | |
| ChemSpider | 144499 | |
| PubChem | 14829 | |
| UNII | V1XJQ704R4 | |
|
[Cu]=O
|
||
|
InChI
InChI=1S/Cu.O/q+2;-2
Key: KKCXRELNMOYFLS-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | polvo pardo a negro | |
| Densidad | 6315 kg/m³; 6,315 g/cm³ | |
| Masa molar | 79.545 g/mol g/mol | |
| Punto de fusión | 1326 °C (1599 K) | |
| Punto de ebullición | 2000 °C (2273 K) | |
| Estructura cristalina | monoclínico, mS8 | |
| Índice de refracción (nD) | 2.63 | |
| Banda prohibida | 1,2 eV | |
| Propiedades químicas | ||
| Solubilidad en agua | insoluble | |
| Solubilidad | soluble en cloruro de amonio, cianuro de potasio insoluble en alcohol, hidróxido de amonio, carbonato amónico |
|
| Termoquímica | ||
| ΔfH0sólido | −156 kJ·mol−1 kJ/mol | |
| S0gas, 1 bar | 43 J·mol−1·K−1 J·mol–1·K | |
| Peligrosidad | ||
| NFPA 704 |
0
2
1
|
|
| Riesgos | ||
| Riesgos principales | no inflamable | |
| Compuestos relacionados | ||
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
Contenido
¿Cómo se forma el Óxido de Cobre(II)?
El óxido de cobre(II) se puede formar de varias maneras. Una forma es cuando el cobre se combina directamente con el oxígeno del aire. Sin embargo, para obtenerlo de forma más pura, es mejor calentando otros compuestos de cobre.
Por ejemplo, se puede calentar:
- Nitrato de cobre(II)
- Hidróxido de cobre(II)
- Carbonato de cobre(II)
Al calentarlos, estos compuestos se descomponen y dejan el óxido de cobre(II) como resultado.
Propiedades Químicas del Óxido de Cobre(II)
El óxido de cobre(II) es un óxido que se comporta como una base. Esto significa que puede reaccionar con ácidos fuertes.
Reacción con Ácidos
Cuando el óxido de cobre(II) se mezcla con ácidos como el ácido clorhídrico, el ácido sulfúrico o el ácido nítrico, se disuelve. Al disolverse, forma nuevas sustancias llamadas sales de cobre(II) y agua.
Por ejemplo:
- Con ácido nítrico: <chem>CuO + 2 HNO3 = Cu(NO3)2 + H2O</chem>
- Con ácido clorhídrico: <chem>CuO + 2 HCl =CuCl2 + H2O</chem>
- Con ácido sulfúrico: <chem>CuO + H2SO4 = CuSO4 + H2O</chem>
Reducción a Cobre Metálico
El óxido de cobre(II) también puede transformarse de nuevo en cobre puro. Esto se logra usando gases como el hidrógeno o el monóxido de carbono. Este proceso se llama reducción.
Por ejemplo:
- Con hidrógeno: <chem>CuO + H2 = Cu + H2O</chem>
- Con monóxido de carbono: <chem>CuO + CO = Cu + CO2</chem>
Estructura del Óxido de Cobre(II)
El óxido de cobre(II) tiene una forma específica en la que sus átomos se organizan, conocida como estructura cristalina. Pertenece a un tipo de estructura llamada monoclínico. En esta estructura, cada átomo de cobre está rodeado por cuatro átomos de oxígeno, formando una figura casi cuadrada y plana.
¿Es seguro el Óxido de Cobre(II)?
Es importante manejar el óxido de cobre(II) con cuidado, especialmente en forma de polvo. Puede ser un irritante si entra en contacto con la piel o los ojos. Por eso, es recomendable usar guantes y protección para los ojos, y trabajar en un lugar con buena ventilación.
A pesar de esto, el cobre es un elemento muy importante para nuestro cuerpo. Es necesario para que muchos tejidos funcionen bien, incluyendo el sistema nervioso y el sistema inmunitario. El óxido de cobre se usa incluso en algunos suplementos vitamínicos como una fuente segura de cobre. También se encuentra en productos de uso diario, como fundas de almohada y calcetines, por sus propiedades beneficiosas para la piel.
Usos del Óxido de Cobre(II)
El óxido de cobre(II) tiene una gran variedad de usos en diferentes campos:
- Pigmento en Cerámica: Se utiliza para dar colores como azul, rojo, verde, gris, rosa o negro a los esmaltes de cerámica.
- Fabricación de Rayón: Ayuda a producir soluciones especiales que se usan para fabricar rayón, un tipo de fibra textil.
- Suplemento Dietético: A veces se añade a la dieta de animales que necesitan más cobre.
- Semiconductor: Funciona como un semiconductor especial en electrónica, lo que significa que puede conducir la electricidad bajo ciertas condiciones.
- Abrasivo: Se usa para pulir equipos ópticos, como lentes de cámaras o telescopios.
- Pilas: Se ha utilizado en la fabricación de pilas secas y húmedas.
- Producción de otras Sales de Cobre: Es un punto de partida para crear otros compuestos de cobre.
- Soldadura: Se emplea en la soldadura con aleaciones de cobre.
- Eliminación de Sustancias Peligrosas: Puede ayudar a eliminar de forma segura materiales dañinos como cianuro o hidrocarburos mediante un proceso llamado oxidación.
Galería de imágenes
Véase también
 En inglés: Copper(II) oxide Facts for Kids
En inglés: Copper(II) oxide Facts for Kids