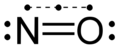Óxido de nitrógeno(II) para niños
Datos para niños
Óxido de nitrógeno |
||
|---|---|---|
 |
||
 Óxido nítrico
|
||
| Nombre IUPAC | ||
| Monóxido de nitrógeno | ||
| General | ||
| Fórmula estructural | 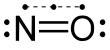 |
|
| Fórmula molecular | NO | |
| Identificadores | ||
| Código ATC | R07AX01 | |
| Número CAS | 10102-43-9 | |
| Número RTECS | QX0525000 | |
| ChEMBL | CHEMBL1200689 | |
| PubChem | 145068 | |
| UNII | 31C4KY9ESH | |
|
[N]=O
|
||
|
InChI
InChI=1S/NO/c1-2
Key: MWUXSHHQAYIFBG-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Gas incoloro | |
| Densidad | 1,27 kg/m³; 0,00127 g/cm³ | |
| Masa molar | 30,01 g/mol | |
| Punto de fusión | −164 °C (109 K) | |
| Punto de ebullición | −152 °C (121 K) | |
| Temperatura crítica | 180 K (−93 °C) | |
| Presión crítica | 63,16 atm | |
| Presión de vapor | 34,2 atm | |
| Viscosidad | 0,0188 cP | |
| Propiedades químicas | ||
| Solubilidad en agua | 5 % | |
| Momento dipolar | 0,15 D | |
| Termoquímica | ||
| ΔfH0gas | 90 kJ/mol | |
| ΔfH0líquido | 87,7 kJ/mol | |
| S0gas, 1 bar | 211 J·mol–1·K | |
| Peligrosidad | ||
| NFPA 704 |
0
3
2
OX
|
|
| Frases R | R23, R24, R25, R34, R44 | |
| Frases S | S23, S36, S37, S39 | |
| Riesgos | ||
| Ingestión | Usado en medicina, pero las sobredosis son perjudiciales. | |
| Inhalación | Peligroso, puede ser fatal. | |
| Piel | Irritante. | |
| Ojos | Puede causar irritación. | |
| Compuestos relacionados | ||
| Óxidos de nitrógeno relacionados | Óxido nitroso Dióxido de nitrógeno Trióxido de dinitrógeno Tetróxido de dinitrógeno Pentóxido de dinitrógeno |
|
| Ácidos relacionados | Ácido nitroso Ácido nítrico |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El óxido nítrico (también conocido como monóxido de nitrógeno) es un gas sin color que se disuelve en agua. Su fórmula química es NO, lo que significa que está formado por un átomo de nitrógeno y uno de oxígeno.
Este gas se encuentra de forma natural en pequeñas cantidades en las células de los mamíferos, incluyendo a los humanos. También está presente en el aire que respiramos, ya que se produce en los motores de los automóviles y en las centrales eléctricas.
Es importante no confundir el óxido nítrico con otros gases parecidos, como el óxido nitroso (N2O) o el dióxido de nitrógeno (NO2). El óxido nítrico es una molécula que cambia muy rápido en el aire. Cuando entra en contacto con el oxígeno, se transforma rápidamente en dióxido de nitrógeno. Por esta razón, se le considera un tipo de "radical libre".
Contenido
¿Cómo se produce el óxido nítrico y qué efectos tiene en el ambiente?
A temperaturas muy altas, el nitrógeno (N2) y el oxígeno (O2) que están en el aire pueden unirse para formar óxido nítrico. Las actividades humanas, como la quema de combustibles, han aumentado mucho la cantidad de este gas en la atmósfera.
Cuando el óxido nítrico está en el aire, puede convertirse en ácido nítrico. Este ácido es uno de los causantes de la lluvia ácida, que puede dañar bosques y edificios. Además, el óxido nítrico y el dióxido de nitrógeno contribuyen al agujero de la capa de ozono, que es una parte de la atmósfera que nos protege de los rayos dañinos del sol.
El óxido nítrico tiene un doble efecto con la luz solar. En la parte baja de la atmósfera, contribuye al calentamiento global. Sin embargo, en la parte alta, ayuda al oscurecimiento global, que es cuando menos luz solar llega a la superficie de la Tierra.
Usos importantes del óxido nítrico
El monóxido de nitrógeno es muy importante en la industria. Es el primer producto que se obtiene al quemar amoníaco de una forma especial (llamada método de Ostwald). Por eso, es clave para fabricar ácido nítrico (HNO3), que se usa en muchos procesos industriales.
En los laboratorios, se puede producir óxido nítrico haciendo reaccionar ácido nítrico diluido con cobre. También se usa para encontrar ciertas partículas (llamadas radicales) en la superficie de los polímeros, que son materiales como el plástico.
El óxido nítrico en la medicina
El óxido nítrico que se inhala se usa en medicina para ayudar a relajar los vasos sanguíneos de los pulmones. Esto es útil en el tratamiento de:
- Bebés recién nacidos (de 34 semanas o más) que tienen problemas graves para respirar debido a una alta presión en los pulmones. El óxido nítrico ayuda a que respiren mejor y reduce la necesidad de usar máquinas especiales para oxigenar su sangre.
- Pacientes de todas las edades que necesitan cirugía de corazón y tienen alta presión en los pulmones. El óxido nítrico ayuda a bajar esa presión, mejora cómo funciona el corazón y la oxigenación.
Reacciones químicas del óxido nítrico
El óxido nítrico reacciona con la mayoría de los halógenos (como el cloro o el flúor) para formar compuestos llamados haluros de nitrosilo.
También puede unirse con el dióxido de nitrógeno para formar otro óxido, el N2O3. Esta mezcla se usa para obtener nitritos.
El dióxido de azufre puede transformar el monóxido de nitrógeno en trióxido de azufre y óxido de dinitrógeno.
Además, el óxido nítrico se usa a veces para mejorar el rendimiento de los motores, ya que al añadir más oxígeno a la combustión, pueden acelerar más rápido y alcanzar mayores velocidades.
El óxido nítrico en nuestro cuerpo
En los años 70, un científico llamado Ferid Murad descubrió que algunos medicamentos usados para el dolor de pecho y problemas del corazón liberan óxido nítrico dentro del cuerpo. Este gas tiene la capacidad de ensanchar los vasos sanguíneos, lo que ayuda a que la sangre fluya mejor. Se dio cuenta de que el óxido nítrico relaja los músculos que rodean los vasos.
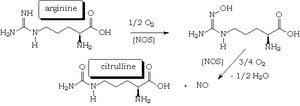
En 1987, se descubrió que el cuerpo humano produce pequeñas cantidades de óxido nítrico a partir de un aminoácido llamado arginina. Esto ayudó a entender cómo funcionan muchos medicamentos para el corazón. Incluso, se ha visto que tratar a pacientes con problemas en las arterias (aterosclerosis) con arginina puede tener un efecto similar.
En el cerebro, el óxido nítrico puede actuar como un neurotransmisor, que son las sustancias que las neuronas usan para comunicarse entre sí.
Todos estos descubrimientos fueron tan importantes que en 1998, los científicos Robert Furchgott, Ferid Murad y Louis J. Ignarro recibieron el premio Nobel por su trabajo. Sin embargo, ha habido cierta discusión sobre este premio, ya que el científico hondureño Salvador Moncada había publicado resultados similares sobre el óxido nítrico y su efecto en el sistema cardiovascular meses antes, en 1987.
El óxido nítrico se produce en el cuerpo gracias a una enzima llamada óxido nítrico sintasa (NOS). Esta enzima usa el aminoácido L-arginina y, con la ayuda de un cofactor (NADPH) y oxígeno, produce óxido nítrico y L-citrulina.
El óxido nítrico es producido por muchos tipos de células en nuestro cuerpo, como las células de la piel, las nerviosas, las que recubren los vasos sanguíneos y las células que combaten infecciones. Hay diferentes tipos de enzimas NOS: algunas producen óxido nítrico constantemente en condiciones normales, y otras se activan solo cuando es necesario, por ejemplo, durante una inflamación.
Cuando las células que recubren los vasos sanguíneos (células endoteliales) producen óxido nítrico, este gas se difunde a los músculos lisos de los vasos. Allí, provoca que los vasos se relajen y se ensanchen, mejorando el flujo sanguíneo. Las células de defensa del cuerpo, llamadas macrófagos, también producen óxido nítrico para destruir microorganismos que han sido capturados.
Gracias a todas estas funciones, el óxido nítrico tiene muchas aplicaciones en la medicina y otras áreas de la salud.
Finalmente, el óxido nítrico también se usa como conservante. Se libera de los nitritos que se emplean para conservar la carne. Curiosamente, algunos virus y microorganismos también liberan óxido nítrico para afectar a las células.
Véase también
 En inglés: Nitric oxide Facts for Kids
En inglés: Nitric oxide Facts for Kids
- Nitratos orgánicos
- Óxidos de nitrógeno
- Dióxido de nitrógeno
- Óxido nitroso
- Ácido nítrico
- Ácido nitroso
Galería de imágenes