Agujero de la capa de ozono para niños
El agujero de la capa de ozono es una zona de la atmósfera terrestre donde la capa de ozono se vuelve más delgada de lo normal. Este fenómeno ocurre cada año durante la primavera en las regiones polares, especialmente en la Antártida. Después de la primavera, la capa de ozono se recupera durante el verano. La cantidad de ozono se mide en unidades Dobson.
Desde finales de los años 1970, los científicos notaron que la capa de ozono se estaba volviendo mucho más delgada, sobre todo en la Antártida. Descubrieron que esto se debía al aumento de ciertos químicos en la estratosfera, como el cloro y el bromo. Estos químicos provenían de productos creados por el ser humano, como los clorofluorocarbonos (CFC), que se usaban en refrigeradores y aerosoles.
La reducción de la capa de ozono causó preocupación mundial. La capa de ozono nos protege de los rayos ultravioleta dañinos del Sol. Sin esta protección, habría más casos de problemas de piel, quemaduras y problemas de visión. También podría dañar plantas y animales. Debido a estas preocupaciones, muchos países firmaron el Protocolo de Montreal en 1987. Este acuerdo buscaba reducir la producción de CFC.
La prohibición de los CFC comenzó en 1989. Los niveles de ozono dejaron de disminuir a mediados de los años 1990 y comenzaron a recuperarse en los años 2000. Se espera que la capa de ozono se recupere por completo y vuelva a los niveles de antes de 1980 alrededor del año 2075. El Protocolo de Montreal es considerado uno de los acuerdos ambientales internacionales más exitosos.
Contenido
¿Qué es la capa de ozono?
La capa de ozono es una parte de la atmósfera de la Tierra que contiene mucho ozono (O3). El ozono es una molécula especial hecha de tres átomos de oxígeno. Esta capa es muy importante porque actúa como un escudo protector para nuestro planeta.
¿Cómo nos protege la capa de ozono?
Casi el 99% de la radiación ultravioleta (UV) del Sol que llega a la estratosfera se convierte en calor. Esto sucede gracias a una reacción química donde las moléculas de ozono se reciclan constantemente. Cuando la luz ultravioleta golpea una molécula de ozono, la divide en átomos de oxígeno. Estos átomos se unen rápidamente de nuevo para formar ozono, liberando calor.
Este proceso continuo de formación y destrucción de ozono absorbe la mayor parte de la radiación UV dañina del Sol. Si no tuviéramos esta capa, la vida en la Tierra sería muy difícil, ya que los rayos UV son peligrosos para los seres vivos.
¿Por qué disminuye el ozono en la atmósfera?
La capa de ozono se encuentra principalmente en la estratosfera, una parte de la atmósfera terrestre. Más del 90% de todo el ozono del planeta está en esta capa. Su función principal es filtrar los rayos ultravioletas del espacio, lo que es vital para la vida en la Tierra.
Los clorofluorocarbonos (CFC)
Desde mediados de los años 1970, los científicos se preocuparon por el efecto de los clorofluorocarbonos (CFC) en la capa de ozono. Los CFC, también conocidos como "freones", se crearon por primera vez en los años 1930. Se usaban mucho como refrigerantes en aires acondicionados y refrigeradores, y también en aerosoles y para limpiar circuitos electrónicos.
Estos compuestos son muy estables y no reaccionan fácilmente. Por eso, pueden viajar lentamente (durante años) hasta la estratosfera sin cambiar. Una vez allí, la radiación UV del Sol los descompone, liberando átomos de cloro. Un solo átomo de cloro puede destruir miles de moléculas de ozono antes de desaparecer. Es como un "catalizador" que acelera la destrucción del ozono.
Los óxidos de nitrógeno
Otro grupo de compuestos que pueden dañar el ozono son los óxidos de nitrógeno. Estos provienen de los gases que expulsan los aviones supersónicos que vuelan muy alto, así como de procesos naturales y actividades humanas. La luz solar descompone algunos de estos óxidos en óxido nítrico, que también ayuda a destruir el ozono.
Causas naturales y humanas
Algunos estudios sugieren que las fuentes naturales de cloro, como los volcanes y los océanos, liberan grandes cantidades de cloro y flúor. Sin embargo, la mayor parte de este cloro natural se disuelve en las nubes y regresa a la Tierra con la lluvia antes de llegar a la estratosfera.
En cambio, los CFC son muy estables y no se disuelven en agua, por lo que sí alcanzan la estratosfera. Aunque los volcanes antárticos liberan cloro, la mayoría de los científicos concuerdan en que los CFC son la causa principal del adelgazamiento de la capa de ozono. La actividad del Sol también puede influir, ya que más radiación UV genera más ozono, pero también más óxidos de nitrógeno que lo destruyen.
El agujero de ozono en los polos
A mediados de los años 80, se descubrió que se había formado un "agujero" en la capa de ozono sobre el polo sur (Antártida) al final del invierno. El ozono se había reducido a la mitad. Este descubrimiento sorprendió a los científicos, ya que la disminución era mucho mayor de lo esperado.
Durante el invierno en la Antártida, se forma una corriente de aire muy fría llamada "torbellino polar". Este torbellino atrapa el aire y lo enfría mucho, lo que permite la formación de nubes de hielo especiales. Estas nubes actúan como una superficie donde los químicos que contienen cloro se transforman en moléculas de cloro muy reactivas.
Cuando llega la primavera y la luz del Sol, estas moléculas de cloro se separan en átomos de cloro. Estos átomos son los que destruyen el ozono. El torbellino polar en la Antártida aísla la región, impidiendo que el aire más cálido y con más ozono de otras partes del mundo llegue al polo para reemplazar el ozono destruido.
En el Ártico (polo norte), la situación es menos grave porque hace menos frío y el torbellino polar no dura tanto tiempo.
La NASA ha señalado que, si no se hubiera firmado el Protocolo de Montreal, para el año 2065 dos tercios de la capa de ozono se habrían destruido, y el "agujero" sería permanente. La radiación ultravioleta habría aumentado mucho, causando quemaduras en la piel en solo cinco minutos de exposición al Sol.
Acciones internacionales para proteger el ozono
En 1976, un informe científico de Estados Unidos mostró pruebas de la disminución del ozono. Esto llevó a países como Canadá, Suecia, Noruega y Estados Unidos a tomar las primeras medidas para eliminar los CFC en aerosoles.
En 1985, veinte países, incluyendo los mayores productores de CFC, firmaron el Convenio de Viena para la protección de la capa de ozono. Este acuerdo buscaba fomentar la investigación y la cooperación para entender mejor la atmósfera y negociar reglas internacionales. Ese mismo año se anunció el descubrimiento del agujero de ozono en la Antártida, lo que hizo que el público prestara más atención al problema.
En 1987, representantes de 43 naciones firmaron el Protocolo de Montreal. Se comprometieron a mantener los niveles de producción de CFC de 1986 y a reducirlos a la mitad para 1999. Sin embargo, con más pruebas científicas sobre el daño causado por los humanos, se firmó un nuevo acuerdo en 1990 en Londres. Los países se comprometieron a eliminar por completo los CFC para el año 2000, permitiendo solo un pequeño porcentaje para usos esenciales, como los inhaladores para el asma. Una nueva reunión en 1992 en Copenhague adelantó la fecha de eliminación a 1996.
Los CFC fueron reemplazados en gran parte por otros compuestos llamados HCFC. Aunque los HCFC no dañan la capa de ozono, sí contribuyen al efecto invernadero.
Las últimas mediciones con satélites muestran que el agujero en la capa de ozono se está haciendo más pequeño. La concentración de CFC ha disminuido desde el año 2000, lo que nos da esperanza de que el agujero de ozono pueda cerrarse a mediados de este siglo.
Ideas comunes sobre el agujero de ozono
- La capa de ozono no es un objeto sólido: La "capa de ozono" es en realidad una zona de la atmósfera donde hay más ozono de lo normal. Por lo tanto, el "agujero" es una zona donde la concentración de ozono es menor.
- Los CFC no son demasiado pesados para llegar a la estratosfera: Aunque los CFC son más pesados que el aire, se mezclan de manera uniforme en los primeros 80 kilómetros de la atmósfera. Como son muy estables, tienen tiempo de subir a la estratosfera.
- Los países que producen CFC están en el hemisferio norte, pero el agujero de ozono está en el hemisferio sur: Los CFC se distribuyen por toda la atmósfera. El agujero de ozono es más notable en la Antártida debido a las temperaturas extremadamente frías que permiten la formación de nubes especiales que aceleran la destrucción del ozono.
- Las fuentes naturales de cloro son mucho más importantes que las humanas: El cloro de fuentes naturales, como los volcanes, se disuelve fácilmente en las nubes y la lluvia lo arrastra de vuelta a la Tierra antes de que llegue a la estratosfera. En cambio, los CFC no se disuelven en agua y son químicamente estables, por lo que sí alcanzan la estratosfera en grandes cantidades.
- El agujero de ozono aparece en invierno, cuando casi no hay luz solar: El ozono es una molécula que se genera con la luz solar. En invierno, su concentración disminuye naturalmente. Sin embargo, lo que se observó en la Antártida es que en primavera, la destrucción del ozono se acelera mucho más de lo que sería normal, lo cual no corresponde a un proceso natural.
Galería de imágenes
-
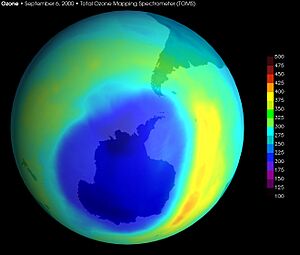
Imagen del agujero más grande de la capa de ozono en la Antártida, registrado en septiembre de 2000. Datos obtenidos por un satélite de la NASA.
Véase también
 En inglés: Ozone depletion Facts for Kids
En inglés: Ozone depletion Facts for Kids


