Ácido para niños
Un ácido (del latín acidus, que significa agrio) es un tipo de compuesto químico que, al disolverse en agua, hace que la solución sea más ácida que el agua pura. Esto se mide con el pH, que en los ácidos es menor que 7.
Una forma sencilla de entender un ácido es como una sustancia que puede "donar" una partícula muy pequeña llamada protón (H+) a otra sustancia. Algunos ejemplos que quizás conozcas son el ácido acético (que está en el vinagre), el ácido clorhídrico (presente en tu estómago para ayudar a digerir la comida) o el ácido sulfúrico (que se usa en las baterías de los coches).
Los ácidos pueden ser sólidos, líquidos o gases, y pueden encontrarse puros o mezclados en soluciones.
Contenido
- ¿Qué es un Ácido?
- Características de los Ácidos
- ¿Cómo se definen los Ácidos?
- ¿Qué tan fuertes son los Ácidos?
- Tipos de Ácidos por su capacidad de donar protones
- Reacciones importantes de los Ácidos
- Usos de los Ácidos en la vida diaria y la industria
- Ácidos en la Biología: Nuestro cuerpo y la naturaleza
- Ejemplos de Ácidos Comunes
- Galería de imágenes
- Véase también
¿Qué es un Ácido?

Características de los Ácidos
Los ácidos tienen varias propiedades que los hacen únicos:
- Tienen un sabor agrio, como el ácido cítrico en las naranjas y los limones. ¡Pero nunca debes probar un ácido desconocido!
- Cambian el color de ciertos papeles especiales, como el papel tornasol azul a rosa.
- Pueden ser corrosivos, lo que significa que pueden dañar o "comer" otros materiales.
- Pueden causar quemaduras en la piel, por eso hay que manejarlos con cuidado.
- Son buenos conductores de la electricidad cuando están disueltos en agua.
- Reaccionan con algunos metales, formando una sal y liberando hidrógeno.
- Reaccionan con las bases para formar sal y agua.
- Reaccionan con óxidos de metales para formar sal y agua.
¿Cómo se definen los Ácidos?
A lo largo de la historia, los científicos han propuesto diferentes formas de entender qué es un ácido.
Ácidos de Arrhenius: La primera idea
El químico sueco Svante August Arrhenius fue uno de los primeros en definir los ácidos en 1884. Para él, un ácido es una sustancia que, al disolverse en agua, aumenta la cantidad de iones hidronio (H3O+). Imagina que el agua (H2O) se separa un poco en iones hidronio (H3O+) y iones hidróxido (OH-). Si añades un ácido de Arrhenius, aumentará la cantidad de H3O+.
Ácidos de Brønsted-Lowry: Donadores de protones
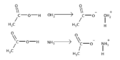
En 1923, los químicos Johannes Nicolaus Brønsted y Thomas Martin Lowry propusieron una definición más amplia. Para ellos, un ácido es una sustancia que "dona" un protón (H+) a otra sustancia, sin importar si están en agua o no. Esta definición es muy útil porque explica más reacciones. Por ejemplo, el ácido acético (del vinagre) dona un protón al agua o al amoníaco.
Ácidos de Lewis: Aceptores de electrones
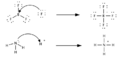
Otro científico, Gilbert N. Lewis, propuso una definición aún más general en 1923. Un ácido de Lewis es una sustancia que puede "aceptar" un par de electrones de otra sustancia. Esta definición es la más amplia de todas, ya que incluye reacciones donde no hay transferencia de protones. Por ejemplo, el trifluoruro de boro (BF3) es un ácido de Lewis porque puede aceptar un par de electrones.
La definición de Brønsted-Lowry es la más usada en química general, a menos que se diga lo contrario.
¿Qué tan fuertes son los Ácidos?
La fuerza de un ácido se refiere a qué tan fácil le resulta "soltar" su protón.
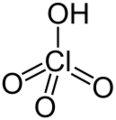
- Un ácido fuerte se disocia (se separa) completamente en agua. Esto significa que si pones un ácido fuerte en agua, casi todas sus moléculas se separarán en iones H+ y su parte restante. Ejemplos son el ácido clorhídrico (HCl) y el ácido sulfúrico (H2SO4).
- Un ácido débil solo se disocia parcialmente. En una solución de ácido débil, algunas moléculas se separan, pero muchas otras permanecen unidas. El ácido acético es un ejemplo de ácido débil.
La fuerza de un ácido se mide con un valor llamado pKa. Cuanto más bajo sea el pKa, más fuerte es el ácido.
Polaridad y el efecto de atracción
La fuerza de un ácido también depende de cómo se distribuyen los electrones en sus enlaces. Si el hidrógeno de un ácido está unido a un átomo muy "atractor de electrones" (electronegativo), el hidrógeno se vuelve más fácil de soltar como protón. Por ejemplo, el ácido fluorhídrico (HF) es más ácido que el agua (H2O) porque el flúor es más electronegativo que el oxígeno.
Tamaño del átomo y fuerza del enlace
Otro factor importante es el tamaño del átomo al que está unido el hidrógeno ácido. Cuanto más grande sea ese átomo, más débil será el enlace con el hidrógeno, y más fácil será que el ácido suelte su protón. Por ejemplo, el ácido clorhídrico (HCl), ácido bromhídrico (HBr) y ácido yodhídrico (HI) son ácidos fuertes, mientras que el ácido fluorhídrico (HF) es débil, a pesar de que el flúor es muy electronegativo. Esto se debe a que el flúor es mucho más pequeño y forma un enlace más fuerte con el hidrógeno.
Tipos de Ácidos por su capacidad de donar protones
Los ácidos se clasifican según cuántos protones pueden donar.
Ácidos monopróticos: Un solo protón
Estos ácidos solo pueden donar un protón por molécula. Por ejemplo, el ácido clorhídrico (HCl) y el ácido nítrico (HNO3) son ácidos monopróticos. Muchos ácidos orgánicos con un solo grupo carboxilo (como el ácido acético) también son monopróticos.
Ácidos polipróticos: Varios protones
Estos ácidos pueden donar más de un protón por molécula.
- Un ácido diprótico puede donar dos protones. El ácido sulfúrico (H2SO4) es un ejemplo: primero dona un protón y luego otro.
- Un ácido triprótico puede donar tres protones. El ácido fosfórico (H3PO4), que se encuentra en algunas bebidas de cola, es un ácido triprótico.
Reacciones importantes de los Ácidos
Neutralización: Ácido + Base
La neutralización es una reacción química donde un ácido y una base se combinan para formar una sal y agua. Por ejemplo, cuando el ácido clorhídrico se mezcla con el hidróxido de sodio (una base), se forma cloruro de sodio (sal de mesa) y agua.
Equilibrio en soluciones de ácidos débiles
Cuando un ácido débil se disuelve en agua, se establece un equilibrio entre el ácido que no se ha separado y los iones que sí lo han hecho. Las soluciones que contienen un ácido débil y una sal de su base conjugada se llaman soluciones tampón. Estas soluciones son muy importantes porque pueden mantener el pH casi constante, incluso si se añaden pequeñas cantidades de ácido o base.
Usos de los Ácidos en la vida diaria y la industria
Los ácidos tienen muchísimas aplicaciones:
- Se usan para limpiar metales, quitando el óxido y la corrosión.
- Son electrolitos en baterías, como el ácido sulfúrico en las baterías de los coches.
- En la industria química, se usan para producir sales. Por ejemplo, el ácido nítrico y el amoníaco forman nitrato de amonio, que es un fertilizante.
- Actúan como catalizadores (sustancias que aceleran las reacciones químicas) en la producción de gasolina.
- Se añaden a alimentos y bebidas para darles sabor o para conservarlos, como el ácido fosfórico en las bebidas de cola.
Ácidos en la Biología: Nuestro cuerpo y la naturaleza
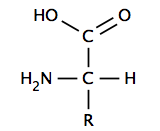
Muchísimas moléculas importantes en los seres vivos son ácidos:
- Los ácidos nucleicos, como el ADN y el ARN, contienen la información genética que nos hace únicos.
- Las proteínas están formadas por unidades más pequeñas llamadas aminoácidos, que también son ácidos.
- Los ácidos grasos son importantes para las membranas celulares de casi todos los organismos.
- En nuestro estómago, el ácido clorhídrico es parte del ácido gástrico que ayuda a digerir los alimentos.
- Algunos animales, como las hormigas, producen ácidos (como el ácido fórmico) para defenderse.
- El equilibrio ácido-base en la sangre es vital para la respiración en los mamíferos. Cuando hacemos ejercicio, producimos más dióxido de carbono, que se convierte en ácido carbónico en la sangre. Esto hace que el pH de la sangre baje, lo que le indica a nuestro cerebro que necesitamos respirar más rápido para eliminar el exceso de dióxido de carbono.
- Muchos medicamentos, como el ibuprofeno y la aspirina, son ácidos débiles. Su forma ácida puede atravesar las membranas de las células para llegar a donde tienen que actuar.
Ejemplos de Ácidos Comunes
Ácidos minerales o inorgánicos
- Ácido clorhídrico (HCl)
- Ácido nítrico (HNO3)
- Ácido fosfórico (H3PO4)
- Ácido sulfúrico (H2SO4)
Ácidos sulfónicos
- Ácido toluenosulfónico
Ácidos carboxílicos
- Ácido acético (en el vinagre)
- Ácido fórmico (en las hormigas)
- Ácido láctico (en la leche agria y los músculos después del ejercicio)
- Ácido oxálico (en algunas verduras como las espinacas)
Ácidos carboxílicos vinílogos
- Ácido ascórbico (Vitamina C)
Galería de imágenes
Véase también
 En inglés: Acid Facts for Kids
En inglés: Acid Facts for Kids