Clorito de sodio para niños
Datos para niños
Clorito de sodio |
||
|---|---|---|
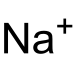 |
||
 |
||
 |
||
| Nombre IUPAC | ||
| Clorito sódico | ||
| General | ||
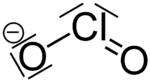
| Fórmula estructural | ||
| Fórmula molecular | NaClO2 | |
| Identificadores | ||
| Número CAS | 7758-19-2 | |
| Número RTECS | VZ4800000 | |
| ChEBI | 78667 | |
| ChEMBL | CHEMBL1887585 | |
| ChemSpider | 22860 | |
| DrugBank | DB13210 | |
| PubChem | 24452 23668197, 24452 | |
| UNII | G538EBV4VF | |
| KEGG | C19523 | |
|
InChI
InChI=InChI=1S/ClHO2.Na/c2-1-3;/h(H,2,3);/q;+1/p-1
Key: UKLNMMHNWFDKNT-UHFFFAOYSA-M |
||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 2500 kg/m³; 2,5 g/cm³ | |
| Masa molar | 90,44 g/mol | |
| Punto de fusión | 170 °C (443 K) | |
| Propiedades químicas | ||
| Solubilidad en agua | 39 g/100 ml (17 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El clorito de sodio (NaClO2) es un compuesto químico que se usa principalmente en la fabricación de papel. También tiene aplicaciones importantes en la purificación de agua y en productos de higiene.
Contenido
¿Cómo se fabrica el clorito de sodio?
El ácido cloroso (HClO2), que es el ácido relacionado con el clorito de sodio, no es muy estable por sí solo. Por eso, no se encuentra como un producto puro en el comercio. Sin embargo, el clorito de sodio, que es una sal, sí es estable y se vende como producto comercial.
Proceso de obtención del clorito de sodio
El clorito de sodio se obtiene a partir del clorato de sodio (NaClO3). Primero, se produce dióxido de cloro (ClO2). Este se logra al reducir el clorato de sodio en una solución ácida. Para ello, se usa un agente reductor, como el cloruro de sodio o el dióxido de azufre.
Luego, el dióxido de cloro se disuelve en una solución alcalina. Finalmente, se reduce con peróxido de hidrógeno (H2O2) para obtener el clorito de sodio.
Usos principales del clorito de sodio
El clorito de sodio se utiliza en varias industrias y aplicaciones. Su uso más importante es para generar dióxido de cloro.
Blanqueo y limpieza
El dióxido de cloro se usa para blanquear y limpiar materiales como textiles, pulpa y papel. Esto ayuda a que estos productos tengan un color más claro y uniforme.
Tratamiento de agua potable
En las plantas de tratamiento de agua, el clorito de sodio se usa para producir dióxido de cloro. Este compuesto ayuda a purificar el agua para que sea segura para beber. Una ventaja de usar dióxido de cloro es que produce menos subproductos no deseados, como los trihalometanos, en comparación con el cloro tradicional.
Productos de higiene y desinfección
El clorito de sodio es un ingrediente en algunos productos de higiene bucal. Se encuentra en enjuagues, pastas dentales y geles. También se usa para limpiar lentes de contacto. Además, se emplea para desinfectar sistemas de ventilación y áreas donde hay animales.
Aplicaciones en química orgánica
En los laboratorios de química, el clorito de sodio se usa para transformar aldehídos en ácidos carboxílicos. Esta reacción se realiza en una solución especial que ayuda a controlar el proceso.
Seguridad al manejar clorito de sodio
El clorito de sodio es un agente oxidante fuerte. Esto significa que puede reaccionar con otros materiales, especialmente los orgánicos. Por esta razón, debe manejarse con cuidado y mantenerse alejado de sustancias que puedan causar una reacción.
Efectos en la salud del clorito de sodio
El clorito de sodio es un oxidante potente. Si se ingiere en grandes cantidades, puede causar problemas de salud. Estos incluyen cambios en la sangre y posibles daños a los riñones.
Las autoridades de salud han establecido límites seguros para el clorito en el agua potable. Por ejemplo, la EPA (Agencia de Protección Ambiental de Estados Unidos) permite un máximo de 1 miligramo de clorito por litro de agua. Este nivel se considera seguro incluso para personas con condiciones médicas especiales.
Información importante sobre el clorito de sodio
Es fundamental saber que el clorito de sodio no es un medicamento. Algunas personas han intentado promoverlo como un remedio para diversas enfermedades. Sin embargo, las autoridades de salud y los expertos médicos han declarado que este producto no es útil para tratar enfermedades y puede ser peligroso.
En muchos países, las agencias de salud han prohibido la venta de productos que promocionan el clorito de sodio como una cura. Es muy importante confiar solo en los tratamientos médicos aprobados y en la información de profesionales de la salud.
Véase también
 En inglés: Sodium chlorite Facts for Kids
En inglés: Sodium chlorite Facts for Kids

