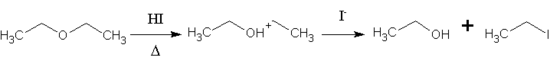Yoduro de hidrógeno para niños
Datos para niños
Yoduro de hidrógeno |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Yoduro de hidrógeno | ||
| General | ||
| Otros nombres | Ácido yodhídrico (cuando está hidratado) | |
| Fórmula semidesarrollada | HI | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 10034-85-2 | |
| Número RTECS | MW3760000 | |
| ChEBI | 43451 | |
| ChEMBL | CHEMBL1233550 | |
| ChemSpider | 23224 | |
| DrugBank | DB15778 | |
| PubChem | 21844680 24841, 21844680 | |
| UNII | 5D3DB66WM3 694C0EFT9Q, 5D3DB66WM3 | |
| KEGG | C05590 | |
|
InChI
InChI=InChI=1S/HI/h1H
Key: XMBWDFGMSWQBCA-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | gas incoloro | |
| Densidad | 2850 kg/m³; 2,85 g/cm³ | |
| Masa molar | 127,904 g/mol | |
| Punto de fusión | 184,55 K (−89 °C) | |
| Punto de ebullición | 237,79 K (−35 °C) | |
| Índice de refracción (nD) | 1,466 | |
| Propiedades químicas | ||
| Acidez | –10,0 pKa | |
| Momento dipolar | 0,38 D | |
| Termoquímica | ||
| ΔfH0gas | ? kJ/mol | |
| ΔfH0líquido | ? kJ/mol | |
| ΔfH0sólido | 0,2072 kJ/mol | |
| S0gas, 1 bar | ? J·mol–1·K | |
| S0líquido, 1 bar | ? J·mol–1·K–1 | |
| S0sólido | ? J·mol–1·K–1 | |
| Capacidad calorífica (C) | 0.2283 | |
| Peligrosidad | ||
| NFPA 704 |
0
3
0
COR
 (C) (C) (T) (T) |
|
| Frases R | 20, 21, 22, 35 | |
| Frases S | 7, 9, 26, 45 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
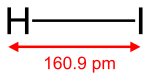
El yoduro de hidrógeno, con la fórmula química HI, es una molécula diatómica. Esto significa que está formada por solo dos átomos: uno de hidrógeno (H) y uno de yodo (I). En condiciones normales, es un gas que no tiene color.
Cuando el yoduro de hidrógeno se disuelve en agua, se convierte en una sustancia llamada ácido yodhídrico. Este ácido es muy fuerte. Tanto el gas yoduro de hidrógeno como el ácido yodhídrico pueden transformarse el uno en el otro. El HI se usa mucho en la química para obtener yodo y como un agente que ayuda a otras sustancias a ganar electrones (un agente reductor).
Contenido
¿Qué es el Yoduro de Hidrógeno?
El yoduro de hidrógeno es un gas que no tiene color. Cuando este gas entra en contacto con el dioxígeno (el oxígeno del aire), reacciona para formar agua y diyodo (yodo en su forma molecular). Si el aire está húmedo, el yoduro de hidrógeno puede verse como una especie de niebla o humo de ácido yodhídrico.
Este gas es muy fácil de disolver en agua. ¡Un solo litro de agua puede disolver hasta 425 litros de yoduro de hidrógeno! Cuando el agua está completamente saturada con HI, solo hay unas pocas moléculas de agua por cada molécula de HI.
El Ácido Yodhídrico como Solución
El ácido yodhídrico es la disolución de yoduro de hidrógeno en agua. Esta mezcla tiene un punto de ebullición especial de 127 °C cuando contiene un 57% de HI y un 43% de agua.
Es uno de los ácidos más fuertes que existen. Esto se debe a que el ion yoduro (la parte de yodo que queda cuando el HI se disuelve) es muy grande. Al ser grande, la carga negativa que tiene se extiende por un volumen mayor. Esto hace que el átomo de hidrógeno se separe fácilmente del yodo, lo que lo convierte en un ácido muy potente.
¿Cómo se Prepara el Yoduro de Hidrógeno?
El yoduro de hidrógeno se puede preparar de varias maneras, tanto en la industria como en el laboratorio.
Métodos Industriales
Una forma de producir HI a gran escala es haciendo reaccionar el diyodo (I2) con una sustancia llamada hidrazina (N2H4). Esta reacción también produce dinitrógeno (gas nitrógeno).
- 2I2 + N2H4 → 4HI + N2
Si esta reacción se hace en agua, el HI que se forma debe ser separado por un proceso llamado destilación.
Otra manera de obtener HI es a partir de una solución de yoduro de sodio o de otro yoduro similar, usando ácido fosfórico concentrado. Es importante saber que el ácido sulfúrico no funciona para esto, ya que reaccionaría de forma diferente con el yoduro.
También se puede preparar haciendo burbujear vapor de sulfuro de hidrógeno a través de una solución de diyodo en agua. Esto forma ácido yodhídrico, que luego se destila, y azufre, que se puede filtrar.
- H2S + I2 → 2HI + S
Métodos de Laboratorio
Para obtener yoduro de hidrógeno muy puro, se puede simplemente combinar hidrógeno (H2) y diyodo (I2).
- H2 + I2 → 2HI
Durante mucho tiempo, se pensó que esta reacción era muy sencilla. Sin embargo, se descubrió que si se ilumina la mezcla de gases con una luz específica, la reacción se acelera mucho. Esto ocurre porque la luz ayuda a que el diyodo se separe en dos átomos de yodo, y estos átomos luego se unen a la molécula de hidrógeno, rompiendo su enlace y formando dos moléculas de HI.
- H2 + I2 + luz → H2 + 2I → I — — — H — — — H — — — I → 2HI
En el laboratorio, otro método es la hidrólisis del triyoduro de fósforo (PI3). En este proceso, el diyodo reacciona con el fósforo para crear triyoduro de fósforo, que luego reacciona con el agua para formar HI y ácido fosforoso (H3PO3).
- 3I2 + 2P + 6H2O → 2PI3 + 6H2O → 6HI + 2H3PO3
Usos y Reacciones del Yoduro de Hidrógeno
El yoduro de hidrógeno puede oxidarse si entra en contacto con el dioxígeno del aire. Esto significa que reacciona con el oxígeno, formando agua y diyodo.
- 4HI + O2 → 2H2O + 2I2
A veces, el HI puede reaccionar con el diyodo para formar HI3, que tiene un color café oscuro.
- HI + I2 → HI3
El HI también se usa en la química orgánica para añadir yodo a ciertas moléculas, como los alquenos. Por ejemplo:
- HI + H2C=CH2 → H3CCH2I
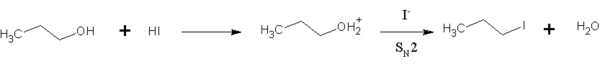
Además, el HI es útil para transformar alcoholes primarios en halogenoalcanos. En esta reacción, el ion yoduro reemplaza un grupo de la molécula de alcohol. El HI es una buena opción para esto porque el ion yoduro es muy efectivo para realizar esta sustitución, lo que permite que la reacción ocurra a una velocidad adecuada sin necesidad de mucho calor. Esta reacción también funciona con otros tipos de alcoholes.
El HI también puede usarse para dividir éteres (un tipo de compuesto químico) en otros compuestos que contienen yodo y alcoholes. Esto es importante porque los éteres suelen ser muy estables, y el HI los convierte en sustancias más reactivas. Por ejemplo, el éter etílico puede dividirse en etanol y yoduro de etilo. La reacción tiende a atacar la parte del éter que es menos "ocupada" por otros átomos.
El ácido yodhídrico también se puede usar para crear yoduro de sodio y yoduro de potasio. Estos compuestos se utilizan para aumentar el contenido de yodo en la sal, lo cual es importante para la salud.
Véase también
 En inglés: Hydrogen iodide Facts for Kids
En inglés: Hydrogen iodide Facts for Kids
- Hidrácido