Tinción para niños
Una tinción o coloración es una técnica especial que se usa en el microscopio para ver mejor las cosas pequeñas. Los colorantes son sustancias que se usan en biología y medicina para hacer que las partes de los tejidos biológicos se vean más claras. Esto ayuda a los científicos a observar con diferentes tipos de microscopios.
Los colorantes pueden usarse para:
- Ver mejor grandes trozos de tejido, como las fibras musculares o el tejido conectivo.
- Clasificar diferentes tipos de células, como las células de la sangre.
- Resaltar partes dentro de una sola célula, llamadas orgánulos.
En bioquímica, la tinción consiste en añadir un colorante que se une a cosas específicas, como el ADN, las proteínas, los lípidos o los carbohidratos. Esto ayuda a saber si un compuesto está presente y en qué cantidad. La tinción y el marcado fluorescente sirven para propósitos similares.
También se usan diferentes tipos de tinciones biológicas para marcar células en citometría de flujo y para marcar proteínas o ácidos nucleicos en electroforesis en gel.
Las tinciones no solo se usan en materiales biológicos. También pueden servir para estudiar la forma de otros materiales, como los polímeros.
Contenido
Tipos de tinción: en vivo y en laboratorio
Existen dos formas principales de teñir muestras:
Tinción en vivo (in vivo)
La tinción in vivo (también llamada tinción vital) es cuando se tiñen tejidos que aún están vivos. Al hacer que ciertas células o partes de ellas tomen color, se puede estudiar dónde están y cómo son mientras funcionan. El objetivo principal es ver detalles de la estructura de las células que de otra manera no se notarían. También puede mostrar dónde se encuentra una sustancia química o dónde ocurre una reacción dentro de las células o tejidos.
Estos colorantes se introducen en el organismo mientras las células están vivas. Para que funcionen bien, se usan en soluciones muy diluidas, como 1 parte de colorante por 5.000 o 50.000 partes de agua. Aunque son útiles, los colorantes pueden ser un poco fuertes para los organismos, algunos más que otros.
Tinción en laboratorio (in vitro)
La tinción in vitro o "supravital" se refiere a teñir células o estructuras que ya han sido sacadas de su entorno biológico. A menudo se usan varios colorantes juntos para ver más detalles que con uno solo. Combinando estas técnicas con la preparación adecuada de las muestras, los científicos y profesionales de la salud pueden usarlas como una herramienta de diagnóstico confiable.
Una contratinción es un colorante adicional que se usa para hacer que las células o estructuras sean más visibles, si el colorante principal no las muestra completamente. Por ejemplo, el cristal violeta solo tiñe las bacterias Gram positivas en la tinción de Gram. Luego se usa un colorante llamado safranina (que tiñe todas las células) para poder identificar también las bacterias Gram negativas.
Es importante saber que muchos colorantes se pueden usar tanto en células vivas como en células que ya no están vivas.
Cómo se prepara una muestra para teñir
Los pasos para preparar una muestra para teñir dependen de lo que se quiera analizar. Algunos o todos los siguientes pasos pueden ser necesarios:
Fijación de la muestra
La fijación es un paso que cambia las propiedades de las proteínas en una célula o tejido para mantener su forma lo mejor posible. A veces se usa calor para fijar la muestra, o más comúnmente, un producto químico. Los fijadores químicos hacen que las proteínas se unan entre sí o con otras sustancias, lo que las hace más resistentes. Algunos fijadores comunes son el formaldehído, el etanol y el metanol.
Los trozos pequeños de tejido se pueden meter en parafina o un polímero, un proceso llamado inclusión. Esto los hace más fuertes y estables, y más fáciles de cortar en rebanadas muy finas. Cuanto más fina es la rebanada, más claros se ven los detalles al microscopio.
Permeabilización de las células
Este paso consiste en tratar las células con un producto suave que disuelve la membrana celular. Así, las moléculas grandes del colorante pueden entrar y llegar a las estructuras dentro de las células.
Montaje de la muestra
El montaje a menudo significa pegar las rebanadas de tejido a un portaobjetos de vidrio para verlas al microscopio. A veces, las células se cultivan directamente sobre el portaobjetos. Si son células sueltas, como en una muestra de sangre, se pueden poner directamente en el portaobjetos.
Para trozos de tejido más grandes, se usa un micrótomo para cortarlos en rebanadas muy delgadas. Estas rebanadas se pegan al portaobjetos con una sustancia transparente, como resina o gelatina. El montaje hace que la muestra sea más resistente para que aguante el proceso de tinción sin perder su forma original.
Proceso de tinción adecuado
En su forma más sencilla, el proceso de tinción puede ser solo sumergir la muestra en la solución de colorante. Esto se hace antes o después de la fijación y el montaje. Luego, se enjuaga para quitar el exceso de colorante y se observa.
Muchos colorantes necesitan un mordiente. Un mordiente es un químico que reacciona con el colorante para formar una sustancia coloreada que no se disuelve. Cuando se enjuaga el exceso de colorante, la tinción con mordiente se queda.
La mayoría de los colorantes para microscopía son "colorantes certificados". Esto significa que una organización independiente, la Biological Stain Commission, ha revisado los colorantes de los fabricantes. Esta organización asegura que los colorantes cumplen con estándares de pureza, concentración y buen funcionamiento. Estos estándares se publican en la revista Biotechnic & Histochemistry. Usar colorantes certificados ayuda a obtener resultados esperados, ya que la composición de los colorantes puede variar entre fabricantes.
Tinción directa
Hablamos de tinción directa cuando el colorante se une directamente a la muestra, sin necesidad de otro tratamiento previo.
Tinción indirecta
Se llama así a las tinciones que usan un mordiente. Un mordiente común es el ácido tánico.
Cómo los tejidos se tiñen de forma diferente
Cuando un tejido o una parte de una célula se tiñe bien con un colorante, se le añade el sufijo -filo o -fílico. Por ejemplo, los tejidos que se tiñen con azure se llaman azurófilos. También se usa para propiedades de tinción más generales:
- Los tejidos que se tiñen con colorantes ácidos (como la eosina) se llaman acidofílicos.
- Los que se tiñen con colorantes básicos (como el azul de metileno) se llaman basofílicos.
- Los que aceptan ambos tipos de colorantes se llaman anfifílicos.
Por el contrario, los tejidos cromófobos no se tiñen fácilmente.
Tinción negativa
Un método sencillo para teñir bacterias, que funciona incluso cuando otros métodos fallan, es la tinción negativa. Esto se logra extendiendo la muestra en un portaobjetos y añadiendo una gota de nigrosina o tinta china. Luego se cubre con un cubreobjetos. Así, los microorganismos se ven claramente como formas claras sobre un fondo oscuro. La tinción negativa es una técnica suave que no daña a los microorganismos, lo que permite estudiarlos más tarde.
Colorantes comunes
La mayoría de los colorantes son compuestos que se unen a partes específicas de las células. Muchos colorantes comunes tienen carga positiva (cationes) y se unen fuertemente a partes de las células con carga negativa, como los ácidos nucleicos. Ejemplos de estos son el azul de metileno, el cristal violeta y la safranina.
Otros colorantes tienen carga negativa (aniones) y se unen a partes de las células con carga positiva, como muchas proteínas. Estos incluyen la eosina y la fucsina ácida. Otro grupo de colorantes se disuelve en grasas; estos se usan para ver dónde están las gotas de grasa en la célula. Un ejemplo es el negro Sudán.
Si solo se quiere aumentar el contraste de las células para verlas mejor, los métodos de tinción simples son suficientes. El azul de metileno es un buen colorante simple que tiñe rápidamente todas las células bacterianas y no produce un color tan oscuro que oculte los detalles. Es muy útil para encontrar bacterias en muestras naturales, ya que la mayor parte del material que no es celular no se tiñe.
Colorantes histológicos más usados
Los diferentes colorantes reaccionan o se concentran en distintas partes de las células o tejidos. Esta propiedad se aprovecha para resaltar áreas específicas. A continuación, se listan algunos de los colorantes biológicos más comunes. La mayoría se usan con células y tejidos fijados, a menos que se indique lo contrario. Las tinciones vitales (que se pueden usar con organismos vivos) están destacadas.
Azul brillante de Coomassie
El Azul de Coomassie tiñe todas las proteínas de un azul intenso. Se usa mucho para teñir proteínas en electroforesis en gel.
Azul de metileno
El azul de metileno se usa para teñir células de animales y plantas, haciendo que sus núcleos sean más visibles. También sirve para ver estructuras de hongos.
Azul de Nilo
El Nile Blue o azul Nilo A, tiñe los núcleos de azul. También se puede usar para teñir células vivas.
Bismarck brown
El Bismarck brown (Marrón Bismarck) da un color amarillo a las mucinas ácidas. Se puede usar con células vivas.
Bromuro de etidio
El bromuro de etidio (BE) se une al ADN y lo hace brillar con un color rojo naranja fluorescente. Aunque no tiñe células vivas porque no atraviesa sus membranas, se usa para identificar células en las últimas etapas de la apoptosis (muerte celular programada), ya que sus membranas son más permeables. Por la misma razón, se usa para marcar la apoptosis en grupos de células y para encontrar bandas de ADN en una electroforesis en gel. Este colorante se puede usar con naranja de acridina (NA) para contar células vivas. Con esta combinación (BE/NA), las células vivas se ven de color verde fluorescente, mientras que las células en apoptosis brillan de un distintivo rojo-naranja.
Carmín de Best
El carmín es un colorante natural rojo intenso. Se puede usar como sal de litio para teñir glucógeno, mientras que las sales de alumbre-carmín tiñen el núcleo. Las tinciones con carmín necesitan un mordiente, que suele ser aluminio o alumbre.
Cristal violeta
El cristal violeta, al combinarse con un mordiente, tiñe las paredes celulares de color púrpura. Es un componente importante en la coloración de Gram.
DAPI
El DAPI es un colorante que tiñe el núcleo. Brilla con luz ultravioleta, produciendo una fuerte fluorescencia azul cuando se une al ADN. El DAPI se une a ciertas regiones del ADN en los cromosomas. No se ve con un microscopio normal. Se puede usar en células vivas o fijadas. La técnica con DAPI es muy buena para contar células.
Eosina
La eosina se usa a menudo como contracoloración de la hematoxilina. Da un color rosado a rojo al material del citoplasma, la membrana celular y algunas estructuras fuera de la célula. También tiñe los eritrocitos (glóbulos rojos) de un rojo intenso. La eosina se puede usar en algunas variantes de la coloración de Gram y en muchos otros métodos de tinción. Hay dos tipos de eosina muy parecidos: la eosina Y (amarillenta) y la eosina B (azulada o rojo imperial). Ambas se pueden intercambiar, y la elección depende de la preferencia.
Fucsina ácida
La fucsina ácida se puede usar para colorear colágeno, músculo liso o mitocondrias. Es parte de la coloración tricrómica de Mallory, donde tiñe el núcleo y el citoplasma. En la tinción de Van Gieson, la fucsina da el color rojo a las fibras de colágeno. También es un colorante tradicional para las mitocondrias.
Hematoxilina
La hematoxilina es un colorante para el núcleo. Hay varias, todas basadas en la hematoxilina extraída del árbol palo campeche. Se usa con un mordiente y tiñe los núcleos de las células de azul violeta a negro. Se usa muy a menudo con eosina en la coloración H&E (hematoxilina y eosina), una de las más comunes en histología.
Hoechst
Hoechst es un compuesto que se une al ADN. Se usa mucho en microscopía de fluorescencia para colorear el ADN. Hoechst es amarillo en agua y emite luz azul con luz ultravioleta. Hay dos tipos principales: Hoechst 33258 y Hoechst 33342. Son similares, pero el 33342 entra mejor en la membrana plasmática.
Yodo
El yodo se usa en química analítica para detectar almidón y otros polisacáridos. Cuando el almidón se mezcla con yodo, se vuelve de un azul intenso. El almidón es común en las células vegetales, así que una solución diluida de yodo puede teñirlo. El yodo también es parte de la coloración de Gram en microbiología. La solución de Lugol es una solución marrón que se vuelve negra con almidones y puede usarse para teñir células, haciendo el núcleo más visible. En la coloración de Gram, el yodo actúa como mordiente, ayudando al colorante a entrar en las células.
Naranja de acridina
El naranja de acridina es un colorante fluorescente que se une a los ácidos nucleicos. Es útil para ver el ciclo celular. Puede atravesar la membrana celular y unirse al ADN y al ARN. Cuando se une al ADN, brilla de forma similar a la fluoresceína. También se puede usar como un colorante general para dar un fondo fluorescente a otras tinciones en muestras de tejidos.
Plata
Una tinción argéntica usa plata para teñir preparaciones histológicas. Es importante para ver proteínas (como el colágeno tipo III) y ADN, tanto dentro como fuera de las células. También se usa en la electroforesis en gel en gradiente de temperatura.
Algunas células argentafines pueden reducir las soluciones de plata a plata metálica después de la fijación. Este método fue descubierto por el fisiólogo italiano Camillo Golgi. Otras células son argirofílicas: solo reducen la plata a su forma metálica después de ser expuestas a un colorante que contiene un agente reductor.
Rodamina
La rodamina es un colorante fluorescente específico para proteínas, usado comúnmente en microscopía fluorescente.
Rojo neutro
El rojo neutro tiñe de rojo los cuerpos de Nissl. A menudo se usa como contracoloración en otras técnicas.
Rojo Nilo
El Rojo Nilo se obtiene hirviendo Azul Nilo con ácido sulfúrico. Es un colorante que se disuelve en grasas y se acumula en las gotas de lípidos dentro de las células, tiñéndolas de rojo. El Rojo Nilo se puede usar con células vivas. Brilla intensamente cuando está en lípidos, pero casi no brilla en soluciones de agua.
Safranina
La safranina (o safranina O) es un colorante para el núcleo. Tiñe los núcleos de las células de rojo y se usa principalmente como contracoloración. También puede dar un color amarillo al colágeno.
Sudán
La coloración de Sudán se usa para resaltar sustancias que se disuelven en grasas, generalmente lípidos. También se usa para ver los niveles de grasa en las heces y diagnosticar ciertas condiciones. Hay varios colorantes de la familia Sudán, como: Sudan III, Sudan IV, Oil Red O y Sudan Black B.
Tetróxido de osmio
El tetróxido de osmio se usa en microscopía óptica para teñir lípidos. Se disuelve fácilmente en grasas y se vuelve osmio metálico al interactuar con material orgánico, dejando un color marrón o negro.
Verde de metilo
El verde de metilo se usa a menudo en microscopía de campo claro para teñir la cromatina de las células y verla mejor.
Verde malaquita
El verde malaquita se puede usar como contracoloración azul-verdosa con safranina, por ejemplo, en la Tinción de Schaeffer-Fulton para bacterias. También se puede usar directamente para teñir endosporas.
Tinciones en microscopía electrónica
Al igual que en la microscopía óptica, se usan sustancias que aumentan el contraste en la microscopía de transmisión electrónica. Generalmente se usan sustancias que absorben electrones, como metales pesados.
Ácido fosfotúngstico
El ácido fosfotúngstico es un colorante negativo común que se usa para resaltar virus, nervios, polisacáridos y otros materiales biológicos.
Tetróxido de osmio
El tetróxido de osmio se usa en microscopía óptica para teñir lípidos. Se disuelve en grasas y se reduce a osmio metálico por el material orgánico, dejando un residuo negro visible. Como es un metal pesado que absorbe electrones, es uno de los colorantes más comunes para ver formas en la microscopía electrónica. También se usa para teñir polímeros. El OsO4 es muy volátil y tóxico. Es un oxidante fuerte.
Tetróxido de rutenio
El tetróxido de rutenio es volátil y aún más fuerte que el tetróxido de osmio, lo que permite teñir materiales que no se tiñen con osmio, como el polietileno.
Otros compuestos químicos
Otros compuestos químicos usados en microscopía electrónica incluyen: molibdato de amonio, yoduro de cadmio, carbohidrázida, cloruro férrico, hexamina, tricloruro de indio, nitrato de lantano, acetato de plomo (II), citrato de plomo, nitrato de plomo (II), ácido peryódico, ácido fosfomolíbdico, ferricianuro de potasio, ferrocianuro de potasio, rojo de rutenio, nitrato de plata, proteinato de plata, cloroaurato de sodio, nitrato de talio, tiosemicarbázida, acetato de uranilo, nitrato de uranilo y sulfato de vanadilo.
Algunas de las tinciones más comunes
Esta lista incluye solo algunas de las tinciones más comunes.
| Tinción | Tipo | Características | Uso | Ejemplo |
|---|---|---|---|---|
| Hematoxilina | Básica / Acidofílica | Tiñe núcleos, ácidos nucleicos y estructuras básicas (mitocondrias y ribosomas) en azul. | Tinción general de tejidos | 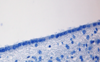 |
| Eosina | Ácida / Basofílica | Tiñe proteínas y estructuras con afinidad por los ácidos en diferentes tonos de rojo. | Tinción general de tejidos |  |
| Tinción hematoxilina-eosina | Bicomponente Anfifílica |
|
Tinción general de tejidos | 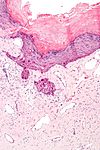 |
| Tinción hemalumbre-eosina | Similar a la tinción H&E con colores más marcados y definidos. | Tinción general de tejidos | 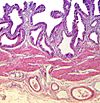 |
|
| Tinción HOPS | Policromática |
|
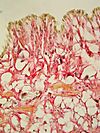 |
|
| Tinción HPS |
|
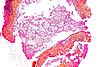 |
||
| Tinción de Papanicolau | Permite ver la cromatina con mucha claridad.
|
Se usa para diferenciar células en muestras de fluidos corporales (esputo, orina, etc.) y en raspados y biopsias. Ayuda a distinguir células con cambios, levaduras y bacterias. | ||
| Tinción de Romanowsky | Pancromática de Romanowsky |
Muestras de sangre |  |
|
| Tinción de Wright | 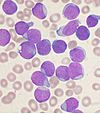 |
|||
| Tinción de Giemsa | 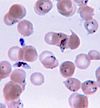 |
|||
| Tinción de Jenner | 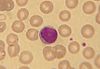 |
|||
| Tinción de Leishman |  |
|||
| Tinción de Field | 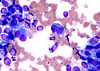 |
|||
| Tinción de May Grünwald | 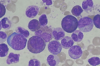 |
|||
| Tinción de May Grünwald-Giemsa | 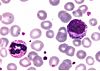 |
|||
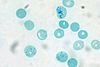
| Tinción con azul brillante de cresilo | Supravital
metacromática |
Tiñe de azul oscuro restos de ácidos nucleicos, y los proteoglicanos ácidos en varios tonos de violeta. | Diagnóstico de anemias
Demostración de estructuras metacromáticas |
 |
| Tinción de Perls | Complexométrica | Tiñe los depósitos de hemosiderina y hierro férrico de color azul-celeste. | Diagnóstico de problemas de la sangre y hemocromatosis | 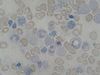 |
| Tinción tricrómica de Masson | Tricrómica |
|
Tiñe fibras, tejido muscular y citoplasmas. | 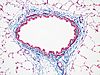 |
| Tinción tricrómica de Lillie | Similar a la tricrómica de Masson. | 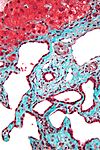 |
||
| Tinción tricrómica AZAN de Heidenhan | Similar a la tricrómica de Masson. Los citoplasmas aparecen en tonos de rojo más profundos y el tejido conectivo en tonos más intensos de azul. | 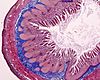 |
||
| Tinción tricrómica de Mallory | Similar a la tricrómica de Masson. | 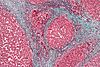 |
||
| Tinción de Van Gieson |
|
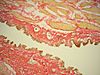 |
||
| Tinción de Movat |
|
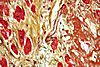 |
||
| Tinción tricrómica de Gömöri | Tricrómica Argéntica |
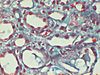 |
||
| Tinción de Warthin-Starry | Argéntica | 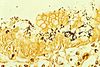 |
||
| Tinción de Von Kossa | Tiñe de tonos de marrón y negro los depósitos de fosfato inorgánico en hueso. | |||
| Tinción de Golgi | 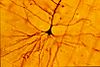 |
|||
| Tinción de Bielchowsky |  |
|||
| Tinción de Jones | 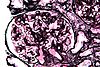 |
|||
| Tinciones para microbiología | ||||
| Tinción de Gram |  |
|||
| Tinción de Ziehl-Neelsen | 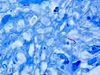 |
|||
| Tinción de Schaeffer-Fulton | Tiñe endosporas de verde y bacterias en rojo. | Sirve para diferenciar endosporas y bacterias. | 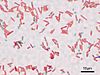 |
|
| Tinción de Conklin | Tiñe endosporas de verde, similar a la tinción de Schaeffer-Fulton. | |||
| Tinción de Grocott | Detección de microorganismos, especialmente hongos. | 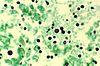 |
||
| Tinción de Dieterle | Búsqueda de microorganismos (por ejemplo, Treponema pallidum). |  |
||
| Tinción negativa | Tiñe el exterior, pero no el interior de células y estructuras. | Es muy usada en microscopía electrónica. En microscopía óptica, para identificar microorganismos con cápsula. | 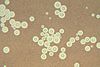 |
|
| Tinción con mucicarmina | Tiñe las paredes celulares de polisacáridos de un intenso color rojo. | Sirve para diferenciar bacterias con pared de polisacáridos de otras que no (por ejemplo, los Cryptococcus son mucicarmina +). | 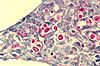 |
|
| Tinciones para orgánulos | ||||
| Tinción metacromática | Produce colores púrpuras y violetas en presencia de mucopolisacáridos ácidos sulfatados. | 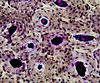 |
||
| Tinciones para fibras | ||||
| Tinción de Weigert | Tiñe fibras elásticas en tonos de azul y violeta. |  |
||
| Tinción con orceína | Tiñe fibras elásticas en tonos de marrón y negro. | 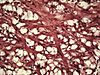 |
||
| Tinciones para carbohidratos | ||||
| Tinción PAS | Tiñe carbohidratos y proteínas glicosiladas de color rojo magenta. | 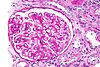 |
||
| Tinción con Lugol | Tiñe el almidón de azul, el glucógeno de amarillo y el resto en tonos de ocre. | 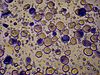 |
||
| Tinción con carmín | Tiñe el glucógeno de intenso color rojo. | 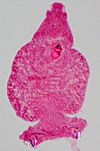 |
||
| Tinciones para proteínas | ||||
| Tinción argéntica | Según la fijación, tiñe proteínas y ácidos nucleicos en tonos de negro y marrón. |  |
||
| Tinción con Rojo Congo | Tiñe el amiloide de un intenso color rojo. | Se usa con hematoxilina/eosina en patología cuando se busca amiloide. | 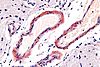 |
|
| Tinción con Alcian Blue | Tiñe mucopolisacáridos ácidos de color azul. | 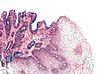 |
||
| Tinción con Azul de Coomassie | Tiñe inespecíficamente proteínas de color azul. | 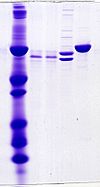 |
||
| Tinciones para ácidos nucleicos | ||||
| Tinción de Feulgen | Tiñe el ADN y los cromosomas de color rojo-violeta. | 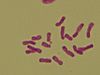 |
||
| Naranja de acridina | Tiñe ADN y cromosomas de color verde fluorescente, ARN y ribosomas en color rojo fluorescente. |  |
||
| DAPI | Tiñe ADN de color azul-celeste fluorescente. | 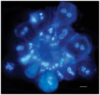 |
||
| Bromuro de etidio | 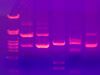 |
|||
| Tinciones para lípidos | ||||
| Tinción con Luxol Fast Blue | Tiñe la mielina de color azul-celeste. | 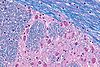 |
||
| Técnica de la Hematina ácida de Baker | Tiñe fosfolípidos y nucleoproteínas de color azul negro. | |||
| Tinción con Oil Red O | Sudán lipofílica |
Tiñe lípidos neutros de color rojo intenso. | 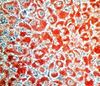 |
|
| Tinción con Sudan Black B | Tiñe gotas de lípidos neutros de color negro azulado. | 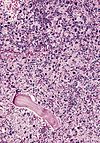 |
||
| Tinción con Sudan II | ||||
| Tinción con Sudan III | Tiñe lípidos neutros de color rojo. | |||
| Tinción con Sudan IV | ||||
Galería de imágenes
-
Un espécimen histológico teñido, colocado entre portaobjetos y cubreobjetos, montado sobre la platina de un microscopio óptico.
Véase también
 En inglés: Staining Facts for Kids
En inglés: Staining Facts for Kids