Hidrocarburo para niños
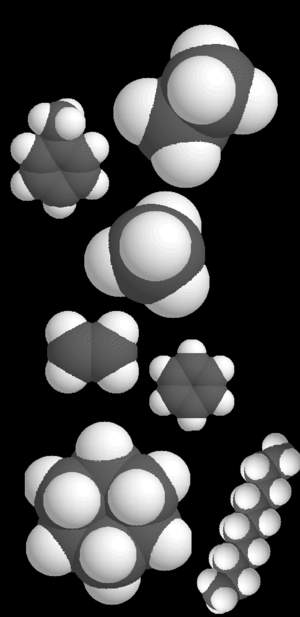
Los hidrocarburos son compuestos químicos especiales que están formados únicamente por átomos de carbono y de hidrógeno. Imagina que el carbono es como un constructor que siempre necesita hacer cuatro "conexiones" o enlaces con otros átomos. Los hidrocarburos son un gran ejemplo de cómo el carbono puede unirse a sí mismo y al hidrógeno de muchas maneras diferentes.
Existen varios tipos de hidrocarburos, como los aromáticos, los alcanos y los cicloalcanos. Todos ellos se basan en estas combinaciones de carbono e hidrógeno.
Las cadenas de átomos de carbono en los hidrocarburos pueden ser como líneas rectas, como ramas de un árbol, o incluso formar anillos cerrados. Si un hidrocarburo tiene otros elementos químicos además de carbono e hidrógeno, se les llama hidrocarburos sustituidos.
Es importante saber que los hidrocarburos son diferentes de los carbohidratos. Los hidrocarburos solo tienen carbono e hidrógeno, y muchos de ellos provienen del petróleo. Los carbohidratos, en cambio, tienen carbono, hidrógeno y también oxígeno. Son azúcares como la glucosa, que nos dan energía. Ambos nos dan energía, pero de formas distintas.
La mayoría de los hidrocarburos que encontramos en la Tierra se hallan de forma natural en el petróleo crudo. Allí, la materia orgánica que se ha descompuesto durante millones de años ha dejado mucho carbono e hidrógeno. Estos átomos se unen y forman cadenas muy largas.
Contenido
¿Cómo se clasifican los Hidrocarburos?
Los hidrocarburos se pueden dividir en dos grandes grupos: los alifáticos y los aromáticos.
Hidrocarburos Alifáticos: Alcanos, Alquenos y Alquinos
Los hidrocarburos alifáticos se clasifican según el tipo de enlaces que unen a los átomos de carbono:
- Alcanos (Hidrocarburos saturados): Son los más sencillos. Todos sus enlaces entre carbonos son simples. Su fórmula general es CnH2n+2. Algunos ejemplos son:
- Alquenos (Hidrocarburos insaturados): Tienen al menos un enlace doble entre dos átomos de carbono. Su fórmula general es CnH2n.
- Alquinos (Hidrocarburos insaturados): Tienen al menos un enlace triple entre dos átomos de carbono. Su fórmula general es CnH2n-2.
Tipos de Estructuras de Hidrocarburos
Según cómo se organicen sus cadenas, los hidrocarburos pueden ser:
- Hidrocarburos acíclicos: Sus cadenas están abiertas. Pueden ser:
- Lineales: No tienen ramas.
- Ramificados: Tienen cadenas laterales.
- Hidrocarburos cíclicos o cicloalcanos: Sus cadenas forman anillos cerrados. Pueden ser:
- Monocíclicos: Tienen un solo anillo.
- Policíclicos: Tienen varios anillos.
Los sistemas policíclicos pueden ser más complejos, como los fusionados (cuando dos anillos comparten un enlace), los espiroalcanos (cuando dos anillos comparten un solo átomo de carbono), los de puente o las agrupaciones (cuando dos anillos independientes se unen).
Los hidrocarburos aromáticos son un grupo especial que tienen al menos una estructura de anillo muy estable, como el benceno.
¿Dónde encontramos los Hidrocarburos?
Los hidrocarburos que se extraen de la Tierra en estado líquido se conocen como petróleo. Los que se encuentran en estado gaseoso se llaman gas natural.
La extracción y el uso de los hidrocarburos son muy importantes para la economía mundial. Son la base de los principales combustibles fósiles (petróleo y gas natural), y también se usan para fabricar plásticos, ceras y lubricantes.
¿Para qué se usan los Hidrocarburos?

Los hidrocarburos son una fuente de energía primaria muy importante para nuestra sociedad. Su uso principal es como combustible. En su forma sólida, los hidrocarburos se encuentran en el asfalto (betún).
Algunas mezclas de hidrocarburos volátiles se usan como propulsores en los aerosoles, porque son más seguros para la capa de ozono que otros químicos que se usaban antes.
El metano (CH4) y el etano (C2H6) son gases a temperatura ambiente. El Propano (C3H8) es fácil de convertir en líquido y se guarda en "botellas de propano" para usarlo como combustible. El etano y el propano también son importantes para crear otras sustancias químicas. El butano (C4H10) es tan fácil de licuar que se usa como combustible seguro en los encendedores pequeños.
El pentano (C5H12) es un líquido incoloro que se usa en la industria como un solvente para ceras y otras sustancias. El Hexano (C6H14) también es un solvente muy usado y es una parte importante de la gasolina común.
Los hidrocarburos con más átomos de carbono, como los que tienen de 6 a 10 carbonos, son los componentes principales de la gasolina, la nafta, el combustible para aviones y otros solventes. A medida que los hidrocarburos tienen más carbonos, se vuelven más espesos, más difíciles de congelar y más oscuros. Los hidrocarburos más pesados, como los alquitranes, se usan para techos, pavimentos y como protectores de madera.
Los hidrocarburos también tienen usos en la naturaleza. Algunas abejas, por ejemplo, usan "olores" únicos de hidrocarburos para reconocer a sus parientes. La composición de estos hidrocarburos puede variar según la edad, el sexo o la posición en la colonia.
¿Cómo reaccionan los Hidrocarburos?
Hay tres tipos principales de reacciones en las que participan los hidrocarburos:
Reacciones de Sustitución
Las reacciones de sustitución ocurren solo en hidrocarburos saturados (los que tienen enlaces simples entre carbonos). En esta reacción, un átomo de un elemento diferente (como el cloro) reemplaza a un átomo de hidrógeno en el hidrocarburo. Por ejemplo:
- CH4 + Cl2 → CH3Cl + HCl
Reacciones de Adición
Las reacciones de adición ocurren con los alquenos y alquinos (los que tienen enlaces dobles o triples). En esta reacción, una molécula se "añade" al hidrocarburo, rompiendo el enlace doble o triple y formando nuevos enlaces.
Reacciones de Combustión
Los hidrocarburos son la principal fuente de energía eléctrica y calor en la actualidad, debido a la gran cantidad de energía que liberan cuando se queman.
Esta energía se usa directamente como calor, por ejemplo, en los calentadores de casas que usan petróleo o gas natural. El hidrocarburo se quema y el calor calienta agua, que luego circula. Un principio similar se usa en las centrales eléctricas para generar electricidad.
Una propiedad común de los hidrocarburos es que, al quemarse, producen vapor de agua, dióxido de carbono y calor. Para que la combustión ocurra, siempre se necesita oxígeno. Por ejemplo, el metano se quema así:
- CH4 + 2 O2 → 2 H2O + CO2 + energía
Si no hay suficiente aire, se puede formar monóxido de carbono, un gas peligroso, y vapor de agua:
- 2 CH4 + 3 O2 → 2 CO + 4 H2O
La quema de hidrocarburos es un ejemplo de una reacción exotérmica, lo que significa que libera calor.
Petróleo
Los hidrocarburos líquidos se llaman petróleo y los gaseosos, gas natural. Ambos se encuentran bajo tierra y son una fuente muy importante de combustible y de materiales para fabricar otros productos químicos.
La extracción de estos combustibles es fundamental para el desarrollo energético moderno. También se pueden obtener hidrocarburos de arenas bituminosas y esquistos bituminosos, que luego se procesan para obtener petróleo sintético.
Las reservas de petróleo en las rocas son la fuente de hidrocarburos para las industrias de energía, transporte y petroquímica.
Los hidrocarburos, junto con otros gases y la luz del sol, contribuyen a la formación de ozono troposférico y a los gases de efecto invernadero.
Seguridad y el Medio Ambiente
Muchos hidrocarburos son muy inflamables, por lo que hay que tener mucho cuidado para evitar accidentes. Algunos hidrocarburos, como el benceno y otros aromáticos, pueden ser dañinos para la salud a largo plazo, por lo que es importante usar equipo de seguridad adecuado para evitar el contacto. Si los hidrocarburos se queman en lugares cerrados, pueden producir monóxido de carbono, que es un gas tóxico. También es importante mantener los hidrocarburos alejados de compuestos de flúor, ya que pueden formar sustancias peligrosas.
La presencia de hidrocarburos en el medio ambiente es un problema importante. Llegan al ambiente por su uso como combustibles y químicos, y también por fugas o derrames accidentales. La contaminación del suelo por hidrocarburos es un problema global serio debido a que estas sustancias permanecen mucho tiempo y pueden afectar la salud de las personas.
Hidrocarburos Sustituidos
Los hidrocarburos sustituidos son compuestos que tienen la misma estructura que un hidrocarburo, pero en lugar de algunos átomos de hidrógeno, tienen átomos de otros elementos. La parte de la molécula que le da sus propiedades químicas especiales se llama grupo funcional.
Por ejemplo, los compuestos halogenados tienen átomos de halógenos (como flúor, cloro, bromo o yodo) como grupo funcional. Se usan en refrigerantes, disolventes, pesticidas y en algunos plásticos.
Microorganismos que Ayudan
Algunos microorganismos tienen la capacidad de adaptarse y cambiar su forma de funcionar para vivir en lugares donde hay hidrocarburos. Estos microorganismos pueden ayudar a descomponer los hidrocarburos, lo que es útil para limpiar la contaminación.
Existen alrededor de 160 tipos de microorganismos que pueden degradar los hidrocarburos, entre ellos:
- Acinetobacter
- Flavobacterium
- Corynebacterium
- Bacillus
- Achromobacter
- Rhodococcus
Véase también
 En inglés: Hydrocarbon Facts for Kids
En inglés: Hydrocarbon Facts for Kids