Reacción de sustitución para niños
Una reacción de sustitución es un tipo de cambio químico donde un átomo o un grupo de átomos en una sustancia es reemplazado por otro átomo o grupo de átomos. Imagina que tienes un equipo de fútbol y un jugador sale del campo para que entre otro en su lugar; algo similar ocurre en estas reacciones, donde una "parte" de una molécula se intercambia por otra.
Estas reacciones son muy importantes en la química, especialmente en la química orgánica, que estudia las sustancias que contienen carbono. Ocurren más fácilmente cuando las sustancias están en estado líquido, gaseoso o disueltas, porque sus partículas están más separadas y pueden interactuar mejor.
Entender cómo funcionan las reacciones de sustitución ayuda a los científicos a predecir qué nuevas sustancias se formarán y cómo hacer que una reacción sea más eficiente, por ejemplo, eligiendo la temperatura o el líquido adecuado para que ocurra.
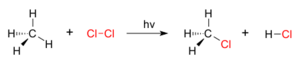
Un ejemplo sencillo es la halogenación, donde un átomo de hidrógeno en una molécula es sustituido por un átomo de un halógeno (como el cloro). Por ejemplo, si el gas cloro (Cl2) se expone a la luz, algunas de sus moléculas se dividen. Uno de los átomos de cloro puede unirse a un átomo de hidrógeno de una molécula de metano (CH4) para formar ácido clorhídrico (HCl), mientras que el otro átoro de cloro se une al resto del metano (CH3) para formar clorometano (CH3Cl).
| Cloración de metano por cloro |
|---|
Contenido
Reacciones de sustitución en la química orgánica
En la química orgánica, las reacciones de sustitución son fundamentales. Se clasifican según el tipo de partícula que realiza la sustitución (si tiene carga positiva o negativa, o si es un radical libre) y el tipo de molécula donde ocurre la sustitución (si es una cadena abierta o un anillo especial llamado compuesto aromático).
Sustitución con halógenos
Una forma común de sustitución es la halogenación radicalaria, que ocurre en sustancias como los alcanos. En este proceso, un átomo de hidrógeno (H) de un alcano (RH) es reemplazado por un átomo de un halógeno (X), como el cloro o el bromo.
- RH + X2 → RX + HX
Sustitución en complejos metálicos
Las reacciones de sustitución también ocurren en la química de coordinación, que estudia los complejos formados por un metal y otras moléculas o iones llamados ligandos. En estos complejos, un ligando puede ser reemplazado por otro.
- M-X + Y → M-Y + X
Aquí, "M" es el metal, "X" es el ligando que se va (el "grupo saliente") e "Y" es el ligando que entra (el "grupo entrante"). Si el ligando que entra es una molécula de agua, se llama "acuatización", y si una molécula de agua es la que se va, se llama "hidrólisis".
Historia de la reacción de sustitución
A principios del siglo XIX, los científicos estaban muy interesados en entender cómo se formaban las sustancias químicas, especialmente las orgánicas. Había varias ideas compitiendo para explicar esto.
Primeras ideas sobre la composición química
Al principio, una de las ideas principales era la teoría dualista-adicional, propuesta por Jöns Jakob Berzelius. Él pensaba que todas las sustancias químicas estaban formadas por dos partes: una con carga positiva y otra con carga negativa, que se unían como los polos opuestos de un imán. Berzelius creía que en una reacción, estas partes se separaban y se volvían a unir de otra manera.
Luego surgió la teoría radical, impulsada por científicos como Justus von Liebig y Friedrich Wöhler. Ellos propusieron que las sustancias estaban hechas de grupos de átomos más pequeños, llamados "radicales", que se mantenían unidos y no cambiaban durante las reacción. Sin embargo, esta idea no explicaba bien por qué las fórmulas de las sustancias a veces solo cambiaban un poco.
El descubrimiento de la sustitución
La idea de la sustitución, donde un átomo o grupo simplemente se intercambia por otro sin que toda la molécula se rompa y se vuelva a formar, fue un gran avance.
Una anécdota famosa involucra a Jean-Baptiste Dumas. Se dice que en una fiesta del rey Carlos X de Francia, las velas producían mucho humo y causaban tos. Dumas investigó y descubrió que el fabricante había usado cloro para blanquear la cera, y este cloro se liberaba al quemarse. Lo importante fue que Dumas demostró que el hidrógeno de la cera había sido reemplazado por el cloro, lo cual contradecía la idea de Berzelius de que un átomo positivo (hidrógeno) no podía ser reemplazado por uno negativo (cloro).
Este descubrimiento llevó a la teoría del tipo, desarrollada por Dumas y luego por Charles Frédéric Gerhardt. Esta teoría clasificaba las sustancias orgánicas en "tipos" y ayudó a entender cómo los átomos se unían y se intercambiaban. También llevó al concepto de valencia, que describe la capacidad de un átomo para combinarse con otros.
Más tarde, Auguste Laurent propuso la teoría nuclear. Él sugirió que las moléculas orgánicas tenían un "núcleo parental" de átomos de carbono, y que otros átomos (como hidrógeno, cloro u oxígeno) se unían a este núcleo y podían ser intercambiados bajo ciertas condiciones.
Estas ideas, aunque diferentes, ayudaron a los científicos a entender que las reacciones químicas no siempre implican una ruptura total y una nueva formación, sino que a menudo son un simple "intercambio" de partes.
Galería de imágenes
Véase también
 En inglés: Substitution reaction Facts for Kids
En inglés: Substitution reaction Facts for Kids