Física atómica para niños
La física atómica es una rama de la física que se dedica a estudiar los átomos. Imagina que un átomo es como un sistema solar diminuto: tiene un centro llamado núcleo atómico y a su alrededor giran unas partículas aún más pequeñas llamadas electrones. La física atómica investiga cómo se comportan estos electrones, cómo se organizan alrededor del núcleo y qué pasa cuando ese orden cambia. También estudia cómo los átomos interactúan entre sí y con la luz.
Es importante saber que la física atómica es diferente de la física nuclear. Mientras que la física atómica se ocupa de todas las partes del átomo, especialmente de los electrones y sus interacciones, la física nuclear se enfoca solo en el núcleo del átomo, que es mucho más complejo. La física atómica se centra en las fuerzas eléctricas y magnéticas que mantienen unido al átomo.
Hoy en día, los científicos que estudian física atómica trabajan en cosas muy interesantes. Por ejemplo, están aprendiendo a enfriar y atrapar átomos e iones para hacer mediciones muy precisas, lo cual es útil para mejorar los relojes atómicos. También buscan medir con más exactitud las constantes físicas fundamentales, lo que ayuda a probar teorías importantes como la relatividad. Además, estudian cómo se comportan los átomos en grupos, como en un condensado de Bose-Einstein.
Contenido
Historia de la Física Atómica
Primeras Ideas sobre los Átomos
La idea de que la materia está hecha de partículas muy pequeñas llamadas "átomos" es muy antigua. Ya en el siglo VI a. C. y el siglo II a. C., pensadores como Demócrito en Grecia y Vaiśeṣika Sūtra en la India hablaban de esto. Sin embargo, no fue hasta el siglo XVIII que el químico y físico británico John Dalton desarrolló esta teoría de una manera más moderna. Él propuso que cada elemento químico estaba formado por un tipo único de átomo.
Descubrimientos Clave
Un gran avance fue la creación de la tabla periódica de los elementos por Dmitri Mendeléyev. Esta tabla organizó los elementos según sus propiedades, lo que ayudó a entender mejor los átomos.
El verdadero inicio de la física atómica moderna llegó con el estudio de las líneas espectrales. Estas son como "huellas dactilares" de la luz que emiten los átomos. Científicos como Joseph von Fraunhofer las estudiaron. Esto llevó al modelo atómico de Bohr, que explicaba cómo los electrones giran alrededor del núcleo en niveles de energía específicos. Este modelo fue un paso crucial para el nacimiento de la mecánica cuántica, una nueva forma de entender el mundo a nivel muy pequeño.
Avances Recientes
Desde la Segunda Guerra Mundial, la física atómica ha avanzado muy rápido. Esto se debe a que las computadoras han permitido crear modelos más complejos de los átomos. También, las mejoras en la tecnología, como los lásers y los aceleradores de partículas, han ayudado mucho a los experimentos.
Átomos Aislados: ¿Por qué se estudian así?
La física atómica se enfoca principalmente en estudiar los átomos de forma individual. Esto significa que los científicos suelen considerar un solo núcleo rodeado por sus electrones. No se preocupan por cómo se forman las moléculas o cómo se comportan los átomos en materiales sólidos. En cambio, estudian procesos como la ionización (cuando un átomo pierde o gana electrones) o la excitación (cuando un electrón salta a un nivel de energía más alto) causadas por la luz o por choques con otras partículas.
Aunque parezca que estudiar átomos aislados no es muy realista, es muy útil. Por ejemplo, en un gas o en un plasma, los átomos están tan separados que las interacciones entre ellos son muy raras. Por eso, se pueden tratar como si estuvieran aislados la mayor parte del tiempo. Así, la física atómica es la base para entender la física del plasma y la física atmosférica.
Configuración Electrónica de los Átomos
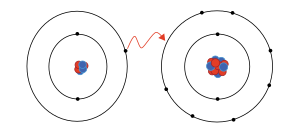
Los electrones se organizan en "capas" alrededor del núcleo. Normalmente, están en su estado de energía más bajo, llamado estado fundamental. Pero pueden absorber energía de la luz (llamada fotones), de campos magnéticos o de choques con otras partículas. Cuando esto sucede, los electrones pueden pasar a un estado de energía más alto, llamado estado excitado.
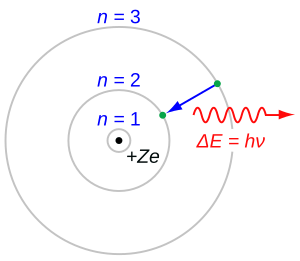
Si un electrón absorbe suficiente energía como para escapar completamente del átomo, se dice que el átomo se ha ionizado. La energía mínima necesaria para que un electrón escape se llama energía de enlace. Cualquier energía extra que el electrón absorba se convierte en energía cinética, es decir, energía de movimiento.
Si el electrón absorbe menos energía que la necesaria para escapar, simplemente salta a una capa de energía más alta. Después de un tiempo, el electrón "salta" de nuevo a un estado de energía más bajo. Cuando esto ocurre, el átomo emite un fotón (una partícula de luz) con la energía que el electrón pierde. Esta es la razón por la que los átomos emiten luz de colores específicos.
A veces, si un electrón de una capa interna es expulsado, un electrón de una capa más externa puede ocupar su lugar. En este proceso, se puede emitir un fotón de luz visible o un rayo X. También puede ocurrir un fenómeno llamado efecto Auger, donde la energía liberada se transfiere a otro electrón, haciendo que este también escape del átomo.
Cómo Interactúan los Átomos
La forma en que los átomos interactúan entre sí es clave para entender la química y las propiedades de los materiales. Estas interacciones se deben a fuerzas fundamentales y se pueden clasificar en varios tipos:
Interacciones de Van der Waals
Las fuerzas de Van der Waals son interacciones débiles entre átomos y moléculas. No implican que los electrones se transfieran o se compartan. Se producen por pequeños cambios temporales en la distribución de los electrones dentro de un átomo o molécula. Esto crea "polos" eléctricos temporales que atraen a otros polos cercanos. Son importantes para entender cómo se comportan las moléculas que no tienen polos permanentes.
- Fuerzas de dispersión de London: Son las más débiles y ocurren por los polos temporales que aparecen y desaparecen rápidamente en los átomos.
- Interacciones dipolo-dipolo: Suceden cuando moléculas que ya tienen polos eléctricos permanentes se atraen entre sí.
- Fuerzas dipolo-inducido: Se forman cuando una molécula con un polo permanente hace que una molécula cercana, que no lo tiene, desarrolle un polo temporal.
Interacciones Iónicas y Covalentes
Estas interacciones son más fuertes y ocurren cuando los electrones se transfieren o se comparten.
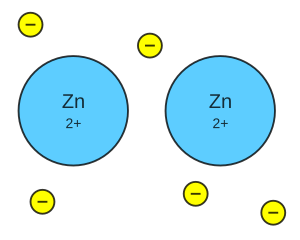
- Enlace iónico: Un átomo le "cede" un electrón a otro. Esto crea iones (átomos con carga eléctrica) de carga opuesta que se atraen fuertemente. Un ejemplo es la sal de mesa (cloruro de sodio), donde el sodio cede un electrón al cloro.
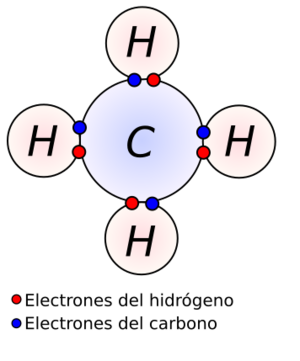
- Enlace covalente: Los átomos "comparten" electrones para completar sus capas externas. Por ejemplo, en una molécula de agua, el oxígeno comparte electrones con los hidrógenos.
Enlace Metálico
El Enlace metálico ocurre en los metales. Aquí, los electrones de las capas exteriores de los átomos se mueven libremente por todo el material, como una "nube" de electrones. Esta nube es la razón por la que los metales son buenos conductores de electricidad y calor, y por qué son dúctiles (se pueden estirar en hilos) y maleables (se pueden moldear).
Fuerzas de Coulomb y Fuerzas Nucleares
- Fuerzas de Coulomb: Son las fuerzas eléctricas que atraen o repelen a las partículas con carga. La atracción entre los electrones (carga negativa) y los protones (carga positiva) en el núcleo mantiene unidos a los átomos.
- Fuerzas nucleares: Son las fuerzas que mantienen unidos a los protones y neutrones dentro del núcleo del átomo. Son muy fuertes, pero solo actúan a distancias muy, muy pequeñas.
Efectos Cuánticos
A nivel atómico, las interacciones se rigen por la mecánica cuántica. Los electrones no son solo bolitas que giran, sino que se comportan como "nubes de probabilidad" en regiones llamadas orbitales. La forma de estos orbitales determina cómo se unen los átomos y cómo interactúan los electrones, lo que explica la estabilidad de las moléculas.
Físicos Atómicos Destacados
Muchos científicos importantes han contribuido a la física atómica:
- Niels Bohr (1885–1962): Físico danés, propuso el modelo de Bohr del átomo, explicando cómo los electrones se mueven en órbitas específicas. Ganó el Premio Nobel de Física en 1922.
- Steven Chu (nacido en 1948): Físico y político estadounidense, ganó el Premio Nobel de Física en 1997 por desarrollar métodos para enfriar y atrapar átomos usando láseres.
- Claude Cohen-Tannoudji (nacido en 1933): Físico francés, también ganó el Premio Nobel de Física en 1997 por sus trabajos en el enfriamiento y atrapamiento de átomos con luz láser.
- Paul Dirac (1902-1984): Físico británico y uno de los fundadores de la física cuántica. Ganó el Premio Nobel de Física en 1933.
- Enrico Fermi (1901-1954): Físico ítalo-estadounidense, conocido por sus trabajos en mecánica cuántica y por lograr la primera reacción en cadena nuclear controlada. Ganó el Premio Nobel de Física en 1938.
- Robert Hofstadter (1915-1990): Físico estadounidense, ganó el Premio Nobel de Física en 1961 por estudiar cómo los electrones se dispersan en los núcleos atómicos.
- Robert Oppenheimer (1904-1967): Físico teórico estadounidense, fue el director científico del Proyecto Manhattan, que desarrolló la bomba atómica.
- Ernest Rutherford (1871-1937): Físico experimental británico, descubrió el núcleo atómico y propuso el modelo atómico de Rutherford. Ganó el Premio Nobel de Química en 1908.
- Johannes Diderik van der Waals (1837–1923): Físico neerlandés, estudió la atracción entre átomos y dio nombre a las fuerzas de Van der Waals. Ganó el Premio Nobel de Física en 1910.
Galería de imágenes
-
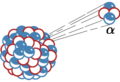
Esquema que explica la emisión alfa. Muestra una partícula alfa (α) expulsada del núcleo de un átomo. Los protones se muestran en rojo y los neutrones en azul.
Véase también
 En inglés: Atomic physics Facts for Kids
En inglés: Atomic physics Facts for Kids
- cronología de la física atómica y subatómica
- física molecular
- modelo de capas electrónico
- Atomismo
- Cambio isomérico
- Antes de la mecánica cuántica
- Después de la mecánica cuántica
- John Dalton
- Clinton Davisson
- Vladímir Fok
- Norman Foster Ramsey
- Charlotte Froese Fischer
- Douglas Hartree
- Daniel Kleppner
- Ratko Janev
- George Paget Thomson
- Isidor Isaac Rabi
- John C. Slater