Fuerzas de Van der Waals para niños
Las fuerzas de Van der Waals son un tipo de fuerzas que actúan entre átomos o moléculas. Pueden ser de atracción o de repulsión. Son diferentes de los enlaces químicos más fuertes que mantienen unidos a los átomos dentro de una molécula, como los enlaces iónicos o covalentes.
Estas fuerzas llevan el nombre del físico neerlandés Johannes Diderik van der Waals (1837-1923). Él fue el primero en describir sus efectos en las ecuaciones que explican cómo se comportan los gases. Por su trabajo, recibió el premio Nobel de Física en 1910.
Contenido
¿Por qué son importantes las fuerzas de Van der Waals?
Las fuerzas de Van der Waals son más débiles que los enlaces químicos normales, pero son muy importantes en muchos campos. Por ejemplo, ayudan a entender cómo funcionan las moléculas en la biología estructural, cómo se comportan los polímeros (materiales como el plástico) y cómo se diseñan cosas muy pequeñas en la nanotecnología.
Estas fuerzas también influyen en las propiedades de muchos compuestos orgánicos, que son la base de la vida. Por ejemplo, determinan si algunas sustancias se disuelven bien en agua o no.
¿Cómo se producen estas fuerzas?
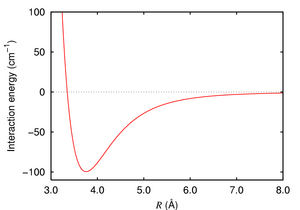
Las fuerzas de Van der Waals surgen de cómo se mueven los electrones en los átomos y las moléculas. Aunque los electrones se mueven muy rápido, a veces se agrupan más en un lado de la molécula que en otro. Esto crea un pequeño desequilibrio eléctrico, como si la molécula tuviera un lado ligeramente positivo y otro ligeramente negativo por un instante. Estos pequeños desequilibrios pueden atraer o repeler a otras moléculas cercanas.
Hay tres tipos principales de fuerzas de Van der Waals:
- Fuerzas de Keesom: Ocurren entre moléculas que ya tienen un lado positivo y un lado negativo de forma permanente (se llaman dipolos permanentes). Un ejemplo es la atracción entre dos moléculas de agua.
- Fuerzas de Debye: Suceden cuando una molécula con un lado positivo y negativo permanente (un dipolo) hace que otra molécula cercana, que normalmente no tiene esos lados, los desarrolle por un momento.
- Fuerzas de dispersión de London: Son las más comunes y ocurren entre todas las moléculas, incluso las que no tienen lados positivos y negativos permanentes. Se deben a los movimientos instantáneos de los electrones, que crean pequeños desequilibrios eléctricos por un momento.
¿Son siempre atractivas estas fuerzas?
Las fuerzas de inducción (Debye) y de dispersión (London) siempre son de atracción. Sin embargo, las fuerzas electrostáticas (Keesom) pueden ser de atracción o de repulsión, dependiendo de cómo estén orientadas las moléculas entre sí.
Cuando las moléculas se mueven mucho, como en un gas o un líquido, las fuerzas electrostáticas pueden ser menos importantes. Esto se debe a que las moléculas giran y experimentan tanto la atracción como la repulsión, lo que promedia el efecto.
Fuerzas de dispersión de London
Las fuerzas de dispersión de London son las más débiles de las fuerzas de Van der Waals, pero son muy importantes. Llevan el nombre del físico Fritz London.
Estas fuerzas ocurren porque los electrones en una molécula están en constante movimiento. Aunque en promedio los electrones están distribuidos de manera uniforme, en cualquier momento pueden estar más concentrados en un lado de la molécula que en el otro. Esto crea un "dipolo instantáneo" o temporal. Este dipolo instantáneo puede influir en las moléculas cercanas, haciendo que también desarrollen dipolos temporales, lo que lleva a una pequeña atracción.
Las fuerzas de London son la única fuerza de atracción que existe entre átomos neutros, como los de un gas noble. Sin estas fuerzas, los gases nobles no podrían convertirse en líquidos.
Estas fuerzas se hacen más fuertes a medida que los átomos o moléculas son más grandes. Esto se debe a que los electrones están más lejos del núcleo y pueden moverse con más facilidad, creando dipolos instantáneos más grandes. Por ejemplo, el diflúor (F2) y el dicloro (Cl2) son gases a temperatura ambiente, pero el dibromo (Br2) es un líquido y el diyodo (I2) es un sólido. Esto se debe a que las moléculas más grandes tienen fuerzas de London más fuertes.
También se hacen más fuertes si las moléculas tienen una mayor superficie de contacto, lo que permite más interacciones cercanas.
Galería de imágenes
-
Los lagartos gecko pueden adherirse a las paredes y techos, debido a las fuerzas de Van der Waals.
Véase también
 En inglés: Van der Waals force Facts for Kids
En inglés: Van der Waals force Facts for Kids