Electrón para niños
Datos para niños Electrón e− |
||
|---|---|---|
 La naturaleza de partícula del electrón se demostró por primera vez con un tubo de Crookes. En esta imagen, un haz de electrones proyecta el perfil en forma de cruz del objetivo contra la cara del tubo.
|
||
| Clasificación | Partículas elementales | |
| Familia | Fermión | |
| Grupo | Leptón | |
| Generación | Primera | |
| Interacción | Gravedad, Electromagnetismo, Nuclear débil |
|
| Antipartícula | Positrón | |
| Teorizada | Richard Laming (1838-1851), G. Johnstone Stoney (1874) y otros. |
|
| Descubierta | J. J. Thomson (1897) | |
| Masa | 9,109 383 701 5(28) × 10−31 kg 5,485 799 090 65(16) × 10−4 uma 0,510 998 950 00(15) MeV/c2 1822.888 484 5(14)−1 u |
|
| Carga eléctrica | −1 e −1,602 176 634 × 10−19 C |
|
| Momento magnético | −1.001 159 652 181 28(18) μB | |
| Carga de color | - | |
| Espín | ± 1/2 | |
En física, el electrón (símbolo e−) es una partícula subatómica con una carga eléctrica negativa. Se considera una partícula elemental, lo que significa que no tiene partes más pequeñas conocidas. Su masa es mucho menor que la de un protón, aproximadamente 1836 veces menos.
Los electrones son parte de la familia de partículas llamadas leptones y participan en fuerzas fundamentales como la gravedad, el electromagnetismo y la fuerza nuclear débil. Al igual que toda la materia, los electrones tienen propiedades de partículas y ondas. Esto significa que pueden chocar con otras partículas y también pueden ser difractados como la luz.
Los electrones son esenciales en muchos fenómenos físicos, como la electricidad y el magnetismo. Un electrón en movimiento crea un campo electromagnético. Junto con los protones y neutrones, los electrones forman los átomos. La fuerza de Coulomb mantiene a los electrones unidos a los protones en un átomo. El intercambio o la compartición de electrones entre átomos es la base de los enlaces químicos.
Contenido
¿Qué es un Electrón?
El electrón es una de las partículas más importantes en el universo. Es una partícula muy pequeña que tiene una carga eléctrica negativa. Los científicos la consideran una partícula fundamental, lo que significa que no está hecha de otras partículas más pequeñas.
Propiedades Clave del Electrón
- Carga eléctrica: El electrón tiene una carga eléctrica negativa. Esta es una de sus características más importantes.
- Masa: Es una partícula muy ligera. Su masa es muchísimo menor que la de un protón, que es otra partícula que se encuentra en el centro de los átomos.
- Espín: Los electrones tienen una propiedad llamada "espín", que es como si giraran sobre sí mismos. Esto los clasifica como fermiones.
- Antipartícula: La antipartícula del electrón se llama positrón. Es igual al electrón, pero tiene una carga eléctrica positiva. Cuando un electrón y un positrón se encuentran, pueden desaparecer y convertirse en fotones de rayos gamma.
¿Cómo interactúan los electrones?
Los electrones interactúan con otras partículas a través de varias fuerzas:
- Gravedad: Como toda la materia, los electrones son afectados por la gravedad.
- Electromagnetismo: Esta es la interacción más importante para los electrones. Es la fuerza que los atrae a las cargas positivas y los repele de las cargas negativas. También es la base de la electricidad y el magnetismo.
- Fuerza nuclear débil: Esta fuerza es responsable de algunos tipos de desintegración radiactiva.
Historia del Descubrimiento del Electrón
La idea de que la electricidad estaba hecha de pequeñas partes indivisibles surgió hace mucho tiempo.
Primeras Ideas sobre la Electricidad
Los antiguos griegos ya notaron que el ámbar (una resina fósil) podía atraer objetos pequeños al frotarlo. Este fue uno de los primeros encuentros de los humanos con la electricidad. En el año 1600, el científico inglés William Gilbert usó la palabra "electricus" para describir esta propiedad. De ahí vienen las palabras "eléctrico" y "electricidad", que derivan de la palabra griega "elektron", que significa ámbar.
En el siglo XVIII, científicos como Benjamin Franklin propusieron que la electricidad era un solo tipo de "fluido" con diferentes "presiones", a las que llamó carga "positiva" y "negativa".
Entre 1838 y 1851, el filósofo británico Richard Laming sugirió que los átomos tenían un centro y estaban rodeados por partículas con carga eléctrica. En 1894, el físico irlandés George Johnstone Stoney propuso el nombre "electrón" para estas pequeñas cantidades de electricidad.
El Descubrimiento Oficial
El electrón fue identificado como una partícula en 1897 por Joseph John Thomson y su equipo en Gran Bretaña. Ellos realizaron experimentos con rayos catódicos (haces de luz en tubos de vacío).
- En 1869, Johann Wilhelm Hittorf observó un brillo en gases enrarecidos.
- En 1876, Eugen Goldstein llamó a estos brillos "rayos catódicos".
- En la década de 1870, William Crookes desarrolló tubos de rayos catódicos con alto vacío y demostró que estos rayos llevaban energía y tenían carga negativa, comportándose como "materia radiante".
- Arthur Schuster continuó estos experimentos y midió la relación entre la masa y la carga de los componentes de los rayos.
- Finalmente, en 1897, J. J. Thomson demostró que los rayos catódicos eran partículas únicas, mucho más ligeras que el átomo más pequeño conocido (el de hidrógeno). A estas partículas las llamó "corpúsculos". Más tarde, se adoptó el nombre de "electrón" para ellas.
La carga exacta del electrón fue medida con gran precisión por los físicos estadounidenses Robert Millikan y Harvey Fletcher en 1909, con su famoso experimento de la gota de aceite.
El Electrón en la Teoría Atómica
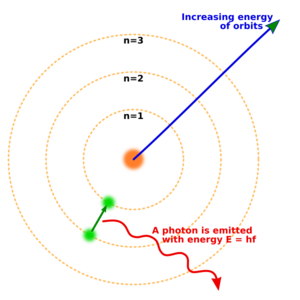
A principios del siglo XX, científicos como Ernest Rutherford y Niels Bohr desarrollaron modelos del átomo.
- En 1913, Niels Bohr propuso que los electrones se mueven en "órbitas" o niveles de energía específicos alrededor del núcleo. Los electrones pueden saltar entre estos niveles al absorber o emitir luz (fotones).
- En 1916, Gilbert Newton Lewis explicó los enlaces químicos diciendo que los átomos comparten electrones.
- En 1924, Wolfgang Pauli formuló el principio de exclusión de Pauli, que dice que dos electrones no pueden ocupar el mismo estado cuántico. Esto explica por qué los electrones se organizan en "capas" alrededor del núcleo.
- En 1925, Samuel Goudsmit y George Uhlenbeck sugirieron que el electrón tiene un "espín" (un giro intrínseco), lo que ayudó a explicar más detalles de los espectros de luz.
El Electrón y la Mecánica Cuántica
La mecánica cuántica es una rama de la física que describe el comportamiento de las partículas muy pequeñas.
- En 1924, Louis de Broglie propuso que los electrones (y toda la materia) pueden comportarse como ondas. Esto se demostró experimentalmente en 1927.
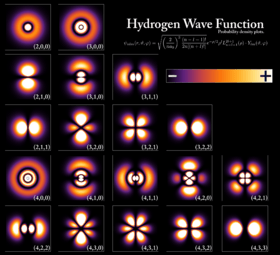
- En 1926, Erwin Schrödinger desarrolló una ecuación que describe cómo se comportan estas "ondas de electrones". Esta ecuación no dice dónde está un electrón exactamente, sino dónde es más probable encontrarlo.
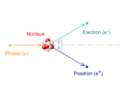
- En 1928, Paul Dirac creó una ecuación que combinaba la mecánica cuántica con la teoría de la relatividad. Esta ecuación predijo la existencia del positrón, la antipartícula del electrón, que fue descubierta en 1932 por Carl David Anderson.
Características del Electrón
Los electrones tienen propiedades muy específicas que los hacen únicos.
Clasificación de los Electrones
En el modelo estándar de física de partículas, los electrones son parte de los leptones. Son los leptones cargados más ligeros y pertenecen a la primera "generación" de partículas fundamentales. Otros leptones cargados son el muon y el tau, que son más pesados pero se comportan de manera similar.
Propiedades Fundamentales del Electrón
- Masa: La masa de un electrón es de aproximadamente 9.109 × 10-31 kilogramos. Es tan pequeña que se necesita una notación científica para expresarla.
- Carga Eléctrica: La carga de un electrón es de -1.602 × 10-19 coulomb. Esta es la unidad básica de carga eléctrica.
- Espín: El espín del electrón es 1/2. Esto significa que se comporta como un pequeño imán.
- Tamaño: Los científicos creen que el electrón no tiene un tamaño conocido; se considera una partícula puntual, es decir, sin dimensiones.
- Estabilidad: Se cree que el electrón es una partícula muy estable y no se desintegra en otras partículas más pequeñas.
¿Cómo se comportan los electrones?
- Dualidad Onda-Partícula: Los electrones pueden actuar como partículas (con una posición definida) o como ondas (extendidas en el espacio). Esto se demuestra en experimentos como el de la doble rendija.
- Partículas Idénticas: Todos los electrones son idénticos. No se puede distinguir un electrón de otro.
- Principio de Exclusión de Pauli: Este principio establece que dos electrones no pueden ocupar el mismo estado cuántico. Esto es crucial para entender cómo se organizan los electrones en los átomos.
- Partículas Virtuales: En el espacio vacío, pueden aparecer y desaparecer muy rápidamente pares de partículas virtuales (como un electrón y un positrón). Estas partículas virtuales afectan las propiedades de los electrones reales.
Interacción de los Electrones

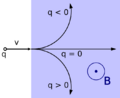
- Campos Eléctricos y Magnéticos: Un electrón crea un campo eléctrico que atrae cargas positivas y repele cargas negativas. Cuando se mueve, también crea un campo magnético.
- Fuerza de Lorentz: Si un electrón se mueve a través de un campo magnético, experimenta una fuerza que lo desvía.
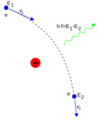
- Interacción con Fotones: Los electrones pueden interactuar con fotones (partículas de luz). Por ejemplo, en el dispersión Compton, un fotón choca con un electrón y le transfiere energía.
- Aniquilación: Cuando un electrón y un positrón (su antipartícula) se encuentran, se aniquilan y producen rayos gamma.
Electrones en Átomos y Moléculas
Los electrones están unidos al núcleo de un átomo por la fuerza eléctrica.
- Orbitales Atómicos: Los electrones en un átomo ocupan regiones específicas llamadas orbitales atómicos. Cada orbital tiene un nivel de energía y solo puede contener un número limitado de electrones.
- Enlaces Químicos: Los enlaces químicos entre átomos se forman cuando los electrones se comparten o se transfieren entre ellos, creando moléculas.
Conductividad Eléctrica

- Carga Neta: Si un objeto tiene más o menos electrones de los que necesita para ser neutro, tendrá una carga eléctrica neta (positiva o negativa).
- Electrones Libres: En metales, algunos electrones pueden moverse libremente. Este movimiento de electrones crea una corriente eléctrica.
- Conductores y Aislantes: Los materiales que permiten que los electrones se muevan fácilmente se llaman conductores (como el cobre). Los que no lo permiten son aislantes (como el vidrio). Los semiconductores están en un punto intermedio.
- Superconductividad: A temperaturas muy bajas, algunos materiales pueden volverse superconductores, lo que significa que los electrones pueden fluir sin ninguna resistencia.
¿Cómo se forman los Electrones?
Los electrones se han formado en diferentes momentos de la historia del universo y se siguen creando hoy en día.
El Universo Temprano
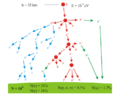
- Big Bang: En los primeros momentos del Big Bang, el universo estaba muy caliente y lleno de energía. Los fotones (partículas de luz) tenían tanta energía que podían crear pares de electrón-positrón.
- Aniquilación y Supervivencia: La mayoría de estos pares se aniquilaron entre sí, pero por razones que aún se estudian, hubo un pequeño exceso de electrones que sobrevivieron.
- Formación de Átomos: Cientos de miles de años después del Big Bang, el universo se enfrió lo suficiente como para que los electrones se unieran a los núcleos atómicos, formando los primeros átomos neutros.
Creación de Electrones Hoy en Día
- Desintegración Beta: Algunos isótopos radiactivos se desintegran y emiten electrones. Este proceso se llama desintegración beta negativa.
- Rayos Cósmicos: Cuando los rayos cósmicos (partículas de alta energía del espacio) chocan con la atmósfera de la Tierra, pueden producir otras partículas que luego se desintegran en electrones.
- Agujeros Negros: Se cree que los agujeros negros pueden emitir electrones (y positrones) a través de un proceso llamado radiación de Hawking.
Observación y Aplicaciones del Electrón
Los electrones son fundamentales para muchas tecnologías modernas.
¿Cómo se observan los Electrones?
- Detección de Radiación: En el espacio, los electrones libres forman plasma que emite energía, la cual puede ser detectada por radiotelescopios.
- Espectroscopia: Cuando los electrones en los átomos cambian de nivel de energía, absorben o emiten luz a frecuencias específicas. Esto crea "líneas espectrales" que los científicos usan para identificar elementos y estudiar materiales.
- Trampas de Partículas: En laboratorios, se usan "trampas" especiales (como la trampa de Penning) para contener electrones individuales y estudiar sus propiedades con gran precisión.
- Imágenes de Electrones: En 2008, científicos de la Universidad de Lund lograron grabar las primeras imágenes del movimiento de un electrón usando pulsos de luz muy cortos.
Aplicaciones de los Haces de Electrones

Los haces de electrones son flujos concentrados de electrones que se utilizan en muchas aplicaciones:
- Soldadura: La soldadura por haz de electrones une materiales con gran precisión.
- Fabricación de Chips: La litografía por haz de electrones se usa para crear circuitos muy pequeños en los semiconductores.
- Tratamiento de Materiales: Los haces de electrones pueden modificar las propiedades de los materiales o esterilizar productos.
- Radioterapia: En medicina, los haces de electrones se usan para tratar algunos tipos de tumores.
- Aceleradores de Partículas: Grandes máquinas llamadas aceleradores de partículas usan campos eléctricos para impulsar electrones a velocidades muy altas, lo que permite a los científicos estudiar las partículas subatómicas.
Creación de Imágenes con Electrones
- Microscopios Electrónicos: Estos microscopios usan haces de electrones en lugar de luz para ver objetos muy pequeños, incluso átomos individuales. Pueden alcanzar una resolución mucho mayor que los microscopios ópticos.
- Hay dos tipos principales: los microscopios de transmisión (TEM) y los microscopios de barrido (SEM).
- Microscopio de Efecto Túnel: Este microscopio usa el "efecto túnel" de los electrones para crear imágenes de la superficie de los materiales a nivel atómico.
Otras Aplicaciones del Electrón
- Láseres de Electrones Libres: Estos láseres producen luz muy brillante y coherente en un amplio rango de frecuencias.
- Tubos de Rayos Catódicos: Antiguamente, se usaban en televisores y monitores de computadora.
- Tubos de Vacío: Fueron esenciales en el desarrollo de la electrónica, aunque ahora han sido reemplazados por transistores.
Galería de imágenes
-
Producción de pares causada por la colisión de un fotón con un núcleo atómico.
-
Las auroras están causadas principalmente por electrones energéticos precipitándose en la atmósfera.
-
El Modelo Estándar de partículas elementales: 12 fermiones fundamentales y 4 bosones fundamentales. Por favor, nótese que las masas de algunas partículas son sujetas a evaluaciones periódicas por la comunidad científica. Los valores actuales reflejados en este gráfico son de 2008 y puede que no hayan sido ajustadas desde ese momento. Para el último consenso, visite el Particle Data Group.
Véase también
 En inglés: Electron Facts for Kids
En inglés: Electron Facts for Kids
- Capa electrónica
- Configuración electrónica
- Modelo estándar de física de partículas
- Electricidad
Fuentes
Notas