Estado de agregación de la materia para niños
En física y química, la materia puede presentarse de diferentes maneras, que llamamos estados de agregación. Estos estados dependen de la temperatura y la presión, y de cómo se unen las pequeñas partículas (como moléculas o átomos) que forman la sustancia.
Cada estado de la materia tiene propiedades distintas. Los cuatro estados más comunes que vemos a diario son el sólido, el líquido, el gas y el plasma. También existen otros estados especiales que no son tan comunes en nuestro planeta, como el condensado de Bose-Einstein o el condensado fermiónico. A veces, la palabra "fase" se usa como sinónimo de estado de la materia.
Contenido
Estados principales de la materia
¿Qué es el estado sólido?
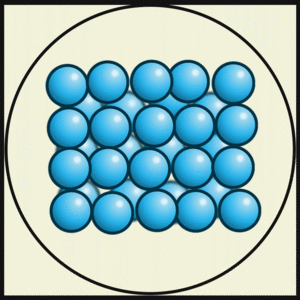
Los objetos en estado sólido tienen una forma definida. Sus átomos suelen estar muy unidos y ordenados, formando estructuras fijas. Esto les permite soportar fuerzas sin cambiar de forma fácilmente. Generalmente, los sólidos son duros y resistentes, porque las fuerzas que unen sus partículas son muy fuertes.
En los sólidos cristalinos, las partículas se organizan en patrones repetitivos y ordenados, como en un cubo o una pirámide. Por ejemplo, el hierro puede tener diferentes estructuras cristalinas según la temperatura. El hielo tiene muchas estructuras cristalinas conocidas, que cambian con la temperatura y la presión.
Los sólidos tienen estas características:
- Las partículas están muy unidas.
- Tienen una forma y un volumen definidos.
- Son difíciles de comprimir.
- Son resistentes a romperse.
- No fluyen.
Los sólidos pueden convertirse en líquidos al calentarse (fusión) y los líquidos pueden volverse sólidos al enfriarse (solidificación). Algunos sólidos pueden pasar directamente a gas sin volverse líquidos (sublimación), y los gases pueden pasar directamente a sólidos (deposición).
¿Qué es el estado líquido?
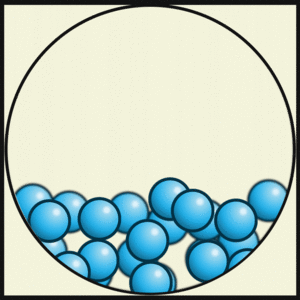
Si un sólido se calienta, sus partículas se mueven más y la estructura ordenada se rompe, convirtiéndose en líquido. La característica principal de los líquidos es que pueden fluir y adaptarse a la forma del recipiente que los contiene. Aunque las partículas aún están unidas, esa unión es mucho menos fuerte que en los sólidos.
Los líquidos tienen estas características:
- Las partículas están menos unidas que en los sólidos.
- Las partículas tienen más energía y se mueven.
- Son fluidos, no tienen forma definida y toman la forma de su recipiente.
- Suelen volverse sólidos con el frío.
- Pueden pasar por pequeños orificios.
- Son difíciles de comprimir.
¿Qué es el estado gaseoso?
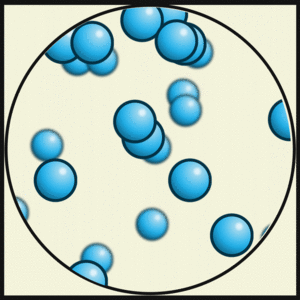
Un gas es un estado de la materia donde las partículas no están unidas, se expanden y tienen muy poca fuerza de atracción entre ellas. Por eso, los gases no tienen un volumen ni una forma definidos, y se expanden hasta llenar cualquier recipiente. Su densidad es mucho menor que la de los líquidos y sólidos.
En un gas, las partículas se mueven muy rápido y libremente, separándose mucho unas de otras. Por eso es fácil comprimir un gas, es decir, acercar sus partículas. Un gas siempre ocupará todo el espacio disponible.
Cuando un gas está por debajo de su temperatura crítica, también se le llama vapor. Un vapor puede convertirse en líquido solo con presión, sin necesidad de enfriarse.
Un fluido supercrítico es un gas que está a una temperatura y presión muy altas, por encima de sus puntos críticos. En este estado, no se puede distinguir si es un líquido o un gas. Por ejemplo, el dióxido de carbono supercrítico se usa para quitar la cafeína del café.
¿Qué es el estado plasmático?
El plasma es un gas especial que está ionizado. Esto significa que algunos átomos han perdido o ganado electrónes, convirtiéndose en iones con carga eléctrica. Así, el plasma está compuesto por iones positivos y negativos que se mueven libremente, lo que lo convierte en un excelente conductor de electricidad. Un ejemplo muy claro de plasma es el Sol.
En la atmósfera terrestre, un átomo puede ionizarse si una partícula rápida lo golpea. Pero a temperaturas muy altas, como en el Sol, las colisiones entre átomos son tan fuertes que liberan electrones. Por eso, gran parte de los átomos en la atmósfera solar están ionizados y se comportan como plasma.
A diferencia de los gases fríos, los plasmas conducen la electricidad y son afectados por los campos magnéticos. Las lámparas fluorescentes y los letreros de neón funcionan con plasma. La electricidad calienta el gas dentro de la lámpara, creando plasma que emite luz.
El plasma en el espacio
La parte superior de la ionosfera de la Tierra se mezcla con la magnetosfera, donde el plasma es más disperso y caliente. Los iones y electrones de la magnetosfera provienen de la ionosfera y del viento solar.
El viento solar es un plasma interplanetario. La capa más externa del Sol, la corona, está tan caliente que todos sus átomos están ionizados, incluso los que tenían muchos electrones. Esta temperatura extrema hace que el plasma de la corona se escape de la gravedad del Sol y se extienda por todo el Sistema Solar.
- Propiedades del plasma
Hay dos tipos de plasma: fríos y calientes.
- En los plasmas fríos, los átomos están a temperatura ambiente, pero los electrones se mueven tan rápido que alcanzan temperaturas muy altas. Sin embargo, como los iones son mucho más pesados y están a temperatura ambiente, no queman al tocarlos.
- En los plasmas calientes, la ionización ocurre por los choques entre los propios átomos al calentarse mucho. Estos átomos ionizados también capturan electrones, y en ese proceso se produce luz (por eso el Sol brilla, al igual que el fuego y los plasmas de laboratorio).
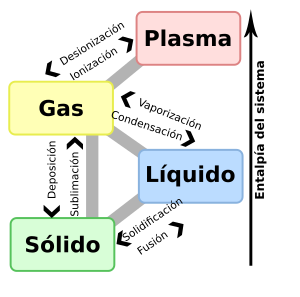
Cambios de estado de la materia
Para cada sustancia, los cambios de estado ocurren bajo ciertas condiciones de presión y temperatura. Cuando hablamos de la temperatura de cambio de estado, nos referimos a la temperatura necesaria bajo la presión normal del aire (1 atm).
Los procesos en los que una sustancia cambia de estado son:
- Fusión: Es el paso de un sólido a líquido al aplicar calor. Durante este proceso, la temperatura se mantiene constante en el "punto de fusión" hasta que todo el sólido se derrite. Por ejemplo, un hielo derritiéndose.
- Solidificación: Es el paso de un líquido a sólido al enfriarse. El "punto de solidificación" o de congelación es la temperatura a la que el líquido se vuelve sólido y coincide con el punto de fusión.
- Vaporización y ebullición: Son los procesos en los que un líquido pasa a estado gaseoso. Si se calienta un líquido hasta su "punto de ebullición", el calor se usa para convertir el líquido en gas sin aumentar la temperatura hasta que todo se haya evaporado.
- Condensación: Es el cambio de un gas a líquido. Es lo contrario de la vaporización. Si un gas pasa directamente a sólido, se llama sublimación inversa.
- Sublimación: Es el paso directo de un sólido a gas, sin pasar por el estado líquido. Un ejemplo es el hielo seco.
- Sublimación inversa: Es el paso directo de un gas a sólido.
- Desionización: Es el cambio de un plasma a gas.
- Ionización: Es el cambio de un gas a plasma.
Es importante recordar que en estos cambios, la sustancia no se transforma en otra diferente, solo cambia su apariencia física.
Los cambios de estado se clasifican en progresivos (cuando se añade energía) y regresivos (cuando se quita energía).
- Cambios progresivos: Vaporización, fusión y sublimación.
- Cambios regresivos: Condensación, solidificación y sublimación inversa.
La siguiente tabla muestra cómo se llaman los cambios de estado:
|
Final
Inicial
|
Sólido | Líquido | Gas | Plasma |
|---|---|---|---|---|
| Sólido | fusión | sublimación | ||
| Líquido | solidificación | evaporación o ebullición | ||
| Gas | sublimación inversa o deposición | condensación | Ionización | |
| Plasma | Desionización |
Estados cuánticos especiales
Condensado de Bose-Einstein
Este estado de la materia fue creado en 1995 por los físicos Eric A. Cornell, Wolfgang Ketterle y Carl E. Wieman, quienes ganaron el Premio Nobel de Física en 2001 por ello. Lograron enfriar átomos a temperaturas extremadamente bajas, tan frías y densas que los átomos casi no se mueven. Este estado fue predicho por Satyendra Nath Bose y Albert Einstein en 1927.
Condensado de Fermi
El condensado fermiónico, considerado el sexto estado de la materia, fue creado por primera vez en 1999 y con átomos en 2003. Es un estado superfluido (que fluye sin fricción) formado por partículas llamadas fermiónes a temperaturas muy bajas, muy cerca del cero absoluto. Es similar al condensado de Bose-Einstein, pero usa fermiones en lugar de bosones.
Supersólido
Este material es un sólido donde los átomos de helio-4 están congelados en una estructura cristalina rígida, como en un sólido normal. La diferencia es que, aunque están "congelados", no están quietos. A temperaturas muy cercanas al cero absoluto, los átomos de helio-4 empiezan a comportarse como sólidos y fluidos al mismo tiempo. Una parte de los átomos se mueve a través de la estructura como un superfluido, sin ninguna fricción. Por eso se le llama "supersólido".
Estados de alta energía
Materia degenerada
Bajo presiones extremadamente altas, como en el centro de estrellas muertas, la materia normal se transforma en estados exóticos llamados materia degenerada. Estos estados se basan en las reglas de la mecánica cuántica. En la materia degenerada, las partículas no pueden ocupar el mismo espacio, lo que las obliga a estar muy juntas. A diferencia del plasma normal, la materia degenerada no se expande mucho al calentarse.
La materia degenerada por electrones se encuentra en las enanas blancas. La materia degenerada en neutrones se encuentra en las estrellas de neutrones, donde la presión es tan grande que los electrones se unen a los protones, formando una masa superdensa de neutrones.
Materia de quarks
En la materia fría normal, los quarks (partículas fundamentales) están unidos en partículas más grandes llamadas hadrones, como los protones y los neutrones. La materia de quarks es un grupo de fases donde los quarks se liberan y pueden moverse libremente. Esto ocurre a densidades o temperaturas extremadamente altas.
El plasma de quarks-gluones es una fase de muy alta temperatura donde los quarks se liberan y se mueven de forma independiente en un "mar" de gluones (partículas que los unen). Este estado se logra por un instante en aceleradores de partículas muy potentes. A diferencia del plasma normal, que fluye como un gas, el plasma de quarks-gluones fluye como un líquido.
Otros posibles estados de la materia
Existen otros estados de la materia que solo se dan en condiciones extremas, como dentro de estrellas muertas o al principio del Big Bang (la gran explosión que dio origen al universo):
- Superfluido
- Materia degenerada
- Materia extraña o materia de quarks
- Cristal líquido
Galería de imágenes
Véase también
 En inglés: States of matter Facts for Kids
En inglés: States of matter Facts for Kids