Fase (materia) para niños
Una fase en las ciencias físicas es como una parte especial de un material o sustancia donde todas sus características son iguales. Imagina un vaso con hielo y agua: el hielo es una fase, el agua líquida es otra fase, y el aire húmedo que está encima es una tercera fase. Incluso el vidrio del vaso es una fase diferente.
Las características que son uniformes dentro de una fase pueden ser la densidad (qué tan pesado es algo para su tamaño), cómo la luz pasa a través de él (su índice de refracción), si es magnético o de qué está hecho químicamente. En resumen, una fase es una parte de un material que es igual en su composición química, se ve diferente físicamente y a menudo se puede separar de otras partes.
A veces, la palabra "fase" se usa como si fuera lo mismo que "estado de la materia" (como sólido, líquido o gas). Pero ¡cuidado! Puede haber varias fases diferentes dentro de un mismo estado de la materia. Por ejemplo, el agua y el aceite son ambos líquidos, pero no se mezclan y forman dos fases líquidas distintas.

Contenido
¿Qué tipos de fases existen?
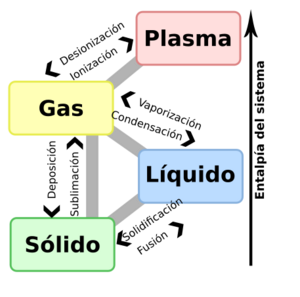
Las fases pueden ser los estados de la materia que ya conoces:
- Gas: Como el aire que respiramos.
- Líquido: Como el agua.
- Sólido: Como el hielo o una roca.
- Plasma: Un gas muy caliente donde los átomos han perdido algunos de sus electrones, como en las estrellas o los rayos.
- Condensado de Bose-Einstein: Un estado muy especial que se forma a temperaturas extremadamente bajas.
Fases dentro de un mismo estado
A veces, dentro de un mismo estado de la materia, pueden existir varias fases distintas.
Por ejemplo, en el estado líquido, el agua y el aceite no se mezclan. El agua es "polar" (le gusta mezclarse con otras cosas polares) y el aceite es "no polar" (no le gusta el agua). Por eso, cuando los juntas, se separan en dos capas o fases líquidas diferentes. Esto se debe a que el agua apenas se disuelve en el aceite, y el aceite apenas se disuelve en el agua. La solubilidad es la cantidad máxima de una sustancia que se puede disolver en otra antes de que deje de disolverse y forme una fase separada.
También puede haber varias fases sólidas. Algunos metales, por ejemplo, pueden formar diferentes tipos de aleaciones (mezclas de metales) que son fases sólidas distintas.
Se han llegado a observar hasta ocho fases líquidas que no se mezclan entre sí. Esto ocurre con líquidos como el agua, algunos aceites, siliconas y metales fundidos.
Emulsiones y coloides
No todas las fases se separan de forma visible y espontánea. Las emulsiones (como la leche o la mayonesa) y los coloides (como la gelatina) son ejemplos donde dos fases que no se mezclarían normalmente, se mantienen dispersas una dentro de la otra gracias a partículas muy pequeñas.
¿Cómo se logra el equilibrio de fases?
Cuando dejas una sustancia tranquila por un tiempo, muchas veces se acomoda en una sola fase uniforme. Pero, dependiendo de la temperatura y la presión, incluso una sola sustancia puede separarse en dos o más fases diferentes. Dentro de cada fase, las características son uniformes, pero entre las fases, las características son distintas.
Imagina un vaso de agua tapado con un poco de aire encima. Este es un sistema de dos fases: el agua líquida y el aire húmedo. Las moléculas de agua están siempre en movimiento. Algunas moléculas de agua líquida ganan suficiente energía y se escapan al aire, convirtiéndose en vapor (evaporación). Al mismo tiempo, algunas moléculas de vapor chocan con la superficie del agua y vuelven a ser líquidas (condensación). Cuando el sistema alcanza el equilibrio, la cantidad de moléculas que se evaporan es igual a la cantidad que se condensa, y no hay un cambio visible en la cantidad de agua líquida o vapor.
A temperatura ambiente, el aire sobre el agua en equilibrio tendrá un 3% de humedad. Si sube la temperatura, este porcentaje aumenta. A 100 °C y presión normal, el aire se vuelve 100% vapor de agua. Si calientas el agua un poco más de 100 °C, el cambio de líquido a gas ocurre en todo el volumen del agua: ¡el agua hierve!
¿Para qué se usa el término "fase"?
La palabra "fase" se usa principalmente para diferenciar dos o más áreas de un material que son uniformes en su composición y propiedades. Esto es importante en la termodinámica, que estudia cómo la energía y la materia se intercambian.
Por ejemplo, cuando el hielo se derrite, cambia de una fase sólida a una fase líquida. Esto se llama una transición de fase. De manera similar, cuando disuelves sal en agua, la sal pasa de una fase sólida a la fase líquida del agua.
A veces, "fase" se usa como sinónimo de "estado de la materia" o para hablar de las diferentes formas en que un mismo material puede cristalizar (lo que se llama polimorfismo).
¿Cuántas fases puede haber?
Para una sustancia dada, solo ciertas fases son posibles a una temperatura y presión específicas. Es difícil predecir cuántas y qué tipos de fases se formarán, por lo que generalmente se descubren con experimentos. Los resultados de estos experimentos se pueden dibujar en diagramas de fase.
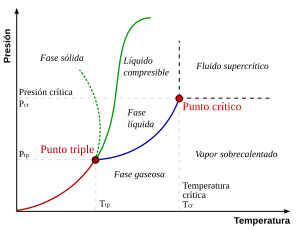
El diagrama de fase
El diagrama de fase que ves aquí es para una sustancia simple. En este tipo de sistema, las fases posibles solo dependen de la presión y la temperatura. Las líneas en el diagrama muestran los puntos donde dos o más fases pueden existir juntas en equilibrio. Lejos de estas líneas, solo habrá una fase en equilibrio.
En el diagrama, la línea azul que separa el líquido del gas no sigue para siempre, sino que termina en un punto llamado punto crítico. A medida que la temperatura y la presión se acercan a este punto, las propiedades del líquido y el gas se vuelven cada vez más parecidas. En el punto crítico, el líquido y el gas son indistinguibles. Por encima de este punto, ya no hay fases separadas de líquido y gas; solo hay un fluido genérico llamado fluido supercrítico. En el agua, el punto crítico ocurre a unos 374 °C y una presión muy alta.
Una característica especial del diagrama de fase del agua es que la línea que separa el sólido del líquido (la línea verde punteada) tiene una inclinación negativa. Para la mayoría de las sustancias, esta línea tiene una inclinación positiva. Esta particularidad del agua se debe a que el hielo es menos denso que el agua líquida. Aumentar la presión hace que el agua pase a la fase de mayor densidad, lo que provoca que el hielo se derrita.
Otra característica interesante del diagrama de fase es el punto donde la línea sólido-líquido se encuentra con la línea líquido-gas. Esta intersección se conoce como el punto triple. En el punto triple, las tres fases (sólida, líquida y gaseosa) pueden coexistir en equilibrio.
¿Qué son los fenómenos interfaciales?
Entre dos fases en equilibrio, hay una zona muy delgada donde las propiedades no son exactamente las de ninguna de las dos fases. Aunque esta región es muy fina, puede tener efectos importantes y fáciles de ver, como la tensión superficial que hace que las gotas de agua sean redondas. En las mezclas, algunos componentes pueden preferir irse a esta zona entre las fases. A veces, para entender mejor un sistema, esta región interfacial se trata como una fase separada.
Fases cristalinas
Un mismo material puede tener varias formas sólidas distintas que pueden formar fases separadas. El agua es un buen ejemplo. El hielo que conocemos normalmente es el hielo Ih (hexagonal), pero también puede existir como hielo cúbico Ic, hielo romboédrico II y muchas otras formas. La capacidad de un sólido para existir en más de una forma cristalina se llama polimorfismo. Para los elementos químicos puros, esto se conoce como alotropía. Por ejemplo, el diamante, el grafito y los fullerenos son diferentes formas de carbono.
¿Qué son las transiciones de fase?
Cuando una sustancia cambia de una fase a otra (por ejemplo, de líquido a gas), generalmente absorbe o libera energía. Por ejemplo, cuando el agua se evapora, las moléculas que se escapan del líquido necesitan energía para vencer las fuerzas que las mantienen unidas. Esta energía la toman del propio calor del agua, lo que hace que el líquido se enfríe. Por eso, la evaporación es útil para enfriar. El proceso contrario, la condensación, libera calor. La energía de calor asociada con el cambio de sólido a líquido se llama entalpía de fusión, y la asociada con el cambio de sólido a gas se llama entalpía de sublimación.
Galería de imágenes
Véase también
 En inglés: States of matter Facts for Kids
En inglés: States of matter Facts for Kids