Capa electrónica para niños
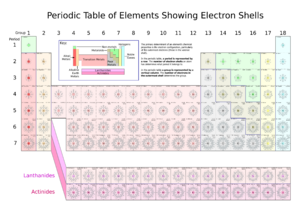
Una capa electrónica es como un "nivel" o "piso" donde los electrones se mueven alrededor del núcleo atómico de un átomo. Piensa en el núcleo como el centro de un edificio y las capas como los diferentes pisos donde los inquilinos (electrones) pueden vivir. Cada capa puede contener un número máximo de electrones y tiene una energía específica, dependiendo de qué tan cerca esté del núcleo.
Los electrones en la capa más externa de un átomo se llaman electrones de valencia. Estos son muy importantes porque determinan cómo un elemento químico se comporta y se une con otros átomos. Es como si fueran los "inquilinos" de la puerta, listos para interactuar con el exterior.
Cada capa tiene un límite de cuántos electrones puede tener:
- La primera capa puede tener hasta 2 electrones.
- La segunda capa puede tener hasta 8 electrones.
- La tercera capa puede tener hasta 18 electrones.
- Y así sucesivamente.
La regla general para saber cuántos electrones puede tener una capa es 2 veces el número de la capa al cuadrado (2n²). Por ejemplo, para la capa 1 (n=1), es 2 * (1*1) = 2 electrones. Para la capa 2 (n=2), es 2 * (2*2) = 8 electrones.
Cada capa está formada por partes más pequeñas llamadas subcapas, y estas subcapas, a su vez, contienen orbitales atómicos, que son las regiones donde es más probable encontrar un electrón.
Contenido
Descubriendo las Capas Electrónicas
Los Primeros Modelos Atómicos
En 1913, el científico Niels Bohr propuso una idea sobre cómo se organizaban los electrones en los átomos. Él imaginó que los electrones giraban alrededor del núcleo en órbitas específicas, como planetas alrededor del sol. Al principio, su modelo explicaba bien los primeros seis elementos, como el Hidrógeno y el Helio.
Observaciones con Rayos X
La existencia de estas capas de electrones fue confirmada por científicos como Charles Barkla y Henry Moseley usando rayos X. Barkla fue el primero en nombrar estas capas con letras: K, L, M, N, O, P y Q. Empezó con la letra K porque pensó que podría haber capas anteriores a la "A" que aún no había descubierto. Más tarde, se vio que estas letras correspondían a los números de las capas (K=1, L=2, etc.).
El trabajo de Moseley fue clave porque demostró que los elementos de la tabla periódica se organizaban mejor por el número de protones en su núcleo (su número atómico), y no por su peso. Como el número de electrones en un átomo neutro es igual al número de protones, esto ayudó mucho a entender la estructura de las capas electrónicas.
El Desarrollo de la Teoría
El concepto de las capas electrónicas se fue perfeccionando con el tiempo. Gilbert Newton Lewis fue importante para entender cómo los electrones de la capa más externa (los de valencia) participan en la formación de enlaces químicos. Más tarde, Linus Pauling amplió esta idea usando principios de la mecánica cuántica.
Otros científicos como Charles Rugeley Bury e Irving Langmuir también hicieron contribuciones importantes, corrigiendo y mejorando el modelo de Bohr. Por ejemplo, ellos propusieron que la primera capa solo podía tener dos electrones, la siguiente ocho, y así sucesivamente.
En 1923, Edmund Stoner descubrió la fórmula 2n² para el número máximo de electrones en cada capa. Luego, en 1925, Wolfgang Pauli añadió un cuarto concepto importante, el "espín" del electrón, lo que completó la teoría moderna de las capas electrónicas.
Nombres y Números de las Capas
Las capas electrónicas se numeran empezando por la más cercana al núcleo. También se les asignan letras:
- Capa K: Es la capa 1 (n = 1), la más interna. Todos los elementos tienen esta capa.
- Capa L: Es la capa 2 (n = 2).
- Capa M: Es la capa 3 (n = 3).
- Capa N: Es la capa 4 (n = 4).
- Capa O: Es la capa 5 (n = 5).
Cuántos Electrones en Cada Capa
El número máximo de electrones que puede tener una capa 'n' es 2n².
- Capa K (n=1): hasta 2 electrones
- Capa L (n=2): hasta 8 electrones
- Capa M (n=3): hasta 18 electrones
- Capa N (n=4): hasta 32 electrones
- Capa O (n=5): hasta 32 electrones (aunque teóricamente podría tener más en elementos muy grandes).
Los electrones se van colocando en las capas empezando por la más cercana al núcleo. Una capa debe estar completamente llena antes de que los electrones empiecen a ocupar la siguiente.
- Un átomo de hidrógeno tiene 1 electrón, así que solo tiene la capa K con 1 electrón.
- Un átomo de helio tiene 2 electrones, que llenan completamente la capa K.
- Un átomo de litio tiene 3 electrones. Los primeros 2 llenan la capa K, y el tercer electrón va a la capa L.
Subcapas: Más Detalles de las Capas
Cada capa se divide en una o más subcapas, y estas subcapas contienen los orbitales atómicos. Piensa en las capas como pisos de un edificio, y las subcapas como diferentes tipos de apartamentos dentro de esos pisos.
Las subcapas se nombran con letras minúsculas: s, p, d, f, y g. Cada tipo de subcapa puede contener un número específico de electrones:
| Tipo de Subcapa | Número máximo de electrones | Capas donde se encuentra |
|---|---|---|
| s | 2 | En todas las capas |
| p | 6 | A partir de la 2ª capa (L) |
| d | 10 | A partir de la 3ª capa (M) |
| f | 14 | A partir de la 4ª capa (N) |
| g | 18 | A partir de la 5ª capa (O) (teóricamente) |
Ejemplos de Llenado de Capas
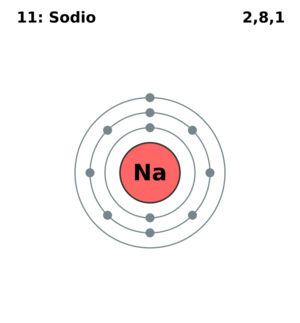
Veamos cómo se distribuyen los electrones en algunos átomos:
- El sodio tiene 11 electrones. Su distribución es: Capa K con 2 electrones, Capa L con 8 electrones, y Capa M con 1 electrón. (K)²(L)⁸(M)¹
A veces, el llenado de las capas no es tan sencillo. Por ejemplo, a partir del potasio (que tiene 19 electrones), las cosas se vuelven un poco más complejas:
- El potasio (19 electrones) tiene la siguiente distribución: (K)²(L)⁸(M)⁸(N)¹.
* Aquí, el electrón número 19 va a la capa N, aunque la capa M aún no está completamente llena (podría tener hasta 18 electrones, pero solo tiene 8). Esto se debe a reglas de energía que hacen que sea más estable para el electrón ir a la capa N.
- Lo mismo ocurre con el calcio (20 electrones): (K)²(L)⁸(M)⁸(N)².
- Sin embargo, para los átomos con un número de electrones entre 20 y 30 (como el escandio), los electrones adicionales vuelven a llenar la capa M antes de seguir llenando la capa N.
Aquí tienes otros ejemplos:
- Argón (18 electrones): (K)²(L)⁸(M)⁸
- Potasio (19 electrones): (K)²(L)⁸(M)⁸(N)¹
- Calcio (20 electrones): (K)²(L)⁸(M)⁸(N) ²
- Escandio (21 electrones): (K)²(L)⁸(M)⁹(N)²
Galería de imágenes
-
Estructura del Vanadio, por ejemplo.
Véase también
 En inglés: Electron shell Facts for Kids
En inglés: Electron shell Facts for Kids