Trióxido de cromo para niños
Datos para niños
Trióxido de cromo |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Trióxido de cromo | ||
| General | ||
| Otros nombres |
Óxido de cromo (VI) |
|
| Fórmula molecular | CrO3 | |
| Identificadores | ||
| Número CAS | 1333-82-0 | |
| Número RTECS | GB6650000 | |
| ChEBI | 48240 | |
| ChemSpider | 14212 | |
| PubChem | 14915 | |
|
InChI
InChI=InChI=1S/Cr.3O
Key: WGLPBDUCMAPZCE-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | rojo oscuro, granular, inodoro | |
| Densidad | 2700 kg/m³; 2,70 g/cm³ | |
| Masa molar | 99,994 g/mol | |
| Punto de fusión | 470 K (197 °C) | |
| Punto de ebullición | 524 K (251 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 61,7 g/100 mL (0 °C) 63 g/100 mL (25 °C) 67 g/100 mL (100 °C) |
|
| Solubilidad | soluble en ácido sulfúrico, ácido nítrico | |
| Peligrosidad | ||
| NFPA 704 |
1
3
1
OX
|
|
| Frases R | R45, R46, R9, R24/25, R26, R35, R42/43, R48/23, R62, R50/53 | |
| Frases S | S53, S45, S60, S61 | |
| Riesgos | ||
| Riesgos principales | Oxidante (O) Carcinógeno Cat. 1 Mutágeno Cat. 2 Repr. Cat. 3 Muy tóxico (T+) Peligroso para el medio ambiente (N) |
|
| Ingestión | Calambres abdominales. | |
| Inhalación | Tos. Dificultad respiratoria. Jadeo. Dolor de garganta. Sibilancia. | |
| Piel | Enrojecimiento. Quemaduras cutáneas. Dolor. | |
| Ojos | Enrojecimiento. Dolor. Pérdida de visión permanente. Quemaduras profundas graves. | |
| LD50 | 80 mg/kg | |
| Más información | ICSC 1194 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El trióxido de cromo, también conocido como óxido de cromo (VI), es un compuesto inorgánico con la fórmula CrO3. Es un tipo de óxido ácido y a veces se vende con el nombre de ácido crómico.
Este compuesto es un sólido de color rojo oscuro o naranja apagado. Se disuelve en agua y, al hacerlo, sufre un cambio químico. Cada año se producen millones de kilogramos de este material. Se usa principalmente en un proceso llamado galvanoplastia.
Contenido
Trióxido de Cromo: Un Compuesto Químico Interesante
El trióxido de cromo es un compuesto químico que tiene muchas aplicaciones importantes. Es conocido por su color distintivo y sus propiedades especiales.
¿Cómo se Fabrica el Trióxido de Cromo?
El trióxido de cromo se fabrica tratando cromato de sodio o dicromato de sodio con ácido sulfúrico. Esta es una reacción química que combina estos materiales para crear el trióxido de cromo.
La reacción se puede escribir así:
- H2SO4 + Na2CrO4 → CrO3 + Na2SO4 + H2O
Cada año se producen alrededor de 100 millones de kilogramos de este compuesto usando este método o similares.
¿Cómo es la Estructura del Trióxido de Cromo?
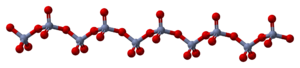
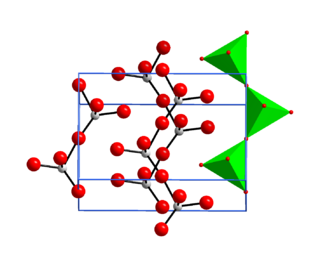
En su forma sólida, el trióxido de cromo está hecho de cadenas de átomos de cromo y oxígeno. Los átomos de cromo están rodeados por cuatro átomos de oxígeno, formando una estructura especial.
Cuando el trióxido de cromo se calienta por encima de los 197 °C, se descompone. Libera oxígeno y se convierte en óxido de cromo (III), que es otro compuesto de cromo.
La reacción de descomposición es:
- 4 CrO3 → 2 Cr2O3 + 3 O2
¿Para Qué se Usa el Trióxido de Cromo?
El uso principal del trióxido de cromo es en el proceso de cromado. Este proceso se utiliza para cubrir objetos con una capa de cromo. Esto les da un acabado brillante y los protege.
Se usa junto con otros aditivos que ayudan en el proceso de galvanizado. El trióxido de cromo también reacciona con metales como el cadmio y el zinc. Esto crea una capa protectora que ayuda a prevenir la corrosión.
Además, el trióxido de cromo se utiliza en la fabricación de rubíes artificiales.
¿Es Peligroso el Trióxido de Cromo?
Es muy importante saber que el trióxido de cromo es un material que debe manejarse con mucho cuidado. Es muy dañino si se ingiere o se inhala. También puede causar quemaduras graves si entra en contacto con la piel o los ojos.
Este compuesto es un ejemplo de un tipo de cromo llamado "cromo hexavalente". Los compuestos de cromo hexavalente pueden ser muy perjudiciales para la salud a largo plazo y para el medio ambiente. Por eso, cuando se trabaja con ellos, se usan sustancias especiales para transformarlos en compuestos de cromo (III), que son mucho menos peligrosos.
El trióxido de cromo es un oxidante muy fuerte. Esto significa que puede reaccionar violentamente con algunos materiales orgánicos, como el etanol, y hacer que se enciendan. Por esta razón, es crucial que solo sea manipulado por expertos en entornos controlados.
Galería de imágenes
Véase también
 En inglés: Chromium(VI) oxide Facts for Kids
En inglés: Chromium(VI) oxide Facts for Kids