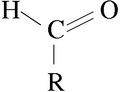
Aldehído para niños
Los aldehídos son un tipo de compuestos orgánicos que tienen una parte especial llamada grupo carbonilo. Este grupo es como un "final" en la molécula, formado por un átomo de carbono unido con un doble enlace a un átomo de oxígeno, y también unido a un átomo de hidrógeno y a otra cadena de átomos de carbono.
La palabra "aldehído" viene del latín y significa "alcohol deshidrogenado", lo que nos da una pista de cómo se pueden formar.
Contenido
¿Cómo son los aldehídos?
Estructura de los aldehídos
En un aldehído, el átomo de carbono central del grupo carbonilo está unido de una forma especial que los químicos llaman hibridación sp2. Esto significa que los enlaces alrededor de ese carbono están en un mismo plano, como si formaran un triángulo. El grupo aldehído es un poco "polar", lo que significa que tiene una parte con una carga eléctrica ligeramente positiva y otra con una carga ligeramente negativa. La distancia entre el carbono y el oxígeno en el doble enlace es muy pequeña, de unos 120-122 picómetros (un picómetro es una billonésima parte de un metro).
Propiedades de los aldehídos
Los aldehídos tienen diferentes propiedades dependiendo de su tamaño y forma.
- Los aldehídos más pequeños, como el formaldehído y el acetaldehído, se mezclan muy bien con el agua.
- Muchos aldehídos que se evaporan fácilmente tienen olores fuertes y característicos.
Los aldehídos pueden comportarse como "reductores", lo que significa que pueden reaccionar y transformarse en otros compuestos, como ácidos, al ganar oxígeno o perder hidrógeno. También son muy reactivos y participan en un tipo de reacción llamada "adición nucleofílica".
¿Para qué se usan los aldehídos?
Los aldehídos se usan en muchas cosas importantes en nuestra vida diaria:
- Se utilizan para fabricar resinas y plásticos, que son materiales muy comunes.
- También son ingredientes en solventes, pinturas, perfumes y esencias.
Aldehídos en la naturaleza
Muchos aldehídos se encuentran en la naturaleza y contribuyen a los olores agradables de los aceites esenciales. Por ejemplo, el cinamaldehído le da su olor a la canela, y la vainillina es el componente principal del aroma de la vainilla.
Aunque no son muy comunes en los bloques de construcción básicos de la vida (como los aminoácidos o los lípidos), la mayoría de los azúcares son en realidad derivados de aldehídos. Por ejemplo, la glucosa, un azúcar muy importante para la energía, tiene un grupo aldehído en su estructura.
El acetaldehído es un compuesto que se forma en nuestro cuerpo cuando procesamos el etanol.
El formaldehído es un aldehído que se usa como conservante en algunos productos cosméticos y para la preservación de ciertas muestras. También se utiliza para fabricar muchos compuestos químicos, como la baquelita y la melamina. Es importante saber que el formaldehído es tóxico y puede ser perjudicial para la salud. Si se ingiere metanol, el cuerpo lo transforma en formaldehído, lo que lo convierte en un veneno muy peligroso.
¿Cómo se nombran los aldehídos?
Los aldehídos se nombran de una manera sencilla. Se toma el nombre del alcohol correspondiente y se cambia la terminación "-ol" por "-al". Por ejemplo, el alcohol de un carbono se llama metanol, así que el aldehído de un carbono se llama metanal.
Sin embargo, los aldehídos más simples tienen nombres comunes que se usan mucho, como:
- El metanal también se conoce como formaldehído.
- El etanal (el aldehído de dos carbonos) se conoce como acetaldehído.
Estos nombres comunes son aceptados por la Unión Internacional de Química Pura y Aplicada (IUPAC), que es la organización que establece las reglas para nombrar los compuestos químicos.
Los aldehídos siempre se encuentran al final de las cadenas de carbono en una molécula.
¿Cómo se obtienen los aldehídos?
Existen varias formas de producir aldehídos. Una de las más importantes en la industria es la hidroformilación, que combina hidrógeno, monóxido de carbono y un alqueno para formar un aldehído. Por ejemplo, así se produce el butiraldehído a partir del propeno.
También se pueden obtener aldehídos a partir de la oxidación de alcoholes primarios. Esto significa que se les añade oxígeno de una manera controlada. En los laboratorios, se usan sustancias especiales para hacer esta reacción, como el dicromato de potasio o el clorocromato de piridinio.
Otra forma de obtener aldehídos es mediante la carbonilación o la reducción de ácidos carboxílicos y sus derivados.
Galería de imágenes
-
Grupo funcional formilo. Los aldehídos poseen un grupo carbonilo (=C=O) unido a una cadena carbonada y a un átomo de hidrógeno.
Véase también
 En inglés: Aldehyde Facts for Kids
En inglés: Aldehyde Facts for Kids