Longitud de enlace para niños
En geometría molecular, la longitud de enlace o distancia de enlace es la distancia promedio entre los centros de dos átomos que están unidos por un enlace químico en una molécula. Imagina que los átomos son pequeñas esferas; la longitud de enlace es la distancia entre el centro de una esfera y el centro de la otra cuando están unidas.
Contenido
¿Qué es la Longitud de Enlace?
La longitud de enlace nos dice qué tan cerca están dos átomos unidos. Esta distancia depende de varios factores importantes:
El Orden de Enlace
El orden de enlace se refiere a cuántos enlaces comparten dos átomos. Puede ser un enlace simple (—), doble (=) o triple (≡).
- Cuantos más enlaces compartan dos átomos, más corta será la distancia entre ellos. Es como si se "jalaran" más fuerte.
Por ejemplo, veamos los enlaces entre átomos de carbono:
| Tipo de Enlace | C-C (simple) | C=C (doble) | C≡C (triple) |
|---|---|---|---|
| Orden de enlace |
|
|
|
| Distancia de enlace (pm) |
|
|
|
Un picómetro (pm) es una unidad de medida muy, muy pequeña, ¡un billón de veces más pequeña que un metro!
El Tamaño de los Átomos
La longitud de enlace también depende del tamaño de los átomos que se unen.
- Si los átomos son grandes, la distancia de enlace será mayor.
- Si los átomos son pequeños, la distancia de enlace será menor.
La longitud de enlace es casi igual a la suma de los "radios covalentes" de los átomos. El radio covalente es como la mitad del tamaño de un átomo cuando está unido.
La Fuerza del Enlace
Un enlace más corto suele ser un enlace más fuerte. Esto significa que se necesita más energía para romperlo.
- La longitud de enlace se relaciona de forma inversa con la fuerza del enlace. Un enlace más fuerte es también un enlace más corto.
¿Cómo se Miden las Longitudes de Enlace?
Las longitudes de enlace se miden usando técnicas especiales, como la cristalografía de rayos X. Esta técnica permite a los científicos "ver" la posición de los átomos en una molécula.
Es importante saber que la longitud de un enlace entre dos átomos puede variar un poco de una molécula a otra. Por ejemplo, el enlace carbono-hidrógeno en el metano es un poco diferente al del cloruro de metilo. Sin embargo, podemos hacer generalizaciones cuando las moléculas son similares.
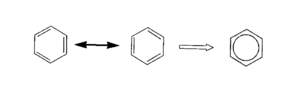
Un ejemplo interesante es el benceno, una molécula con forma de anillo. Todos sus enlaces carbono-carbono tienen la misma longitud, que es de 139 pm. Esta distancia es intermedia entre un enlace simple (154 pm) y un enlace doble (134 pm).
Longitudes de Enlace del Carbono con Otros Elementos
El carbono es un elemento muy versátil que puede unirse con muchos otros. A continuación, se muestra una tabla con las longitudes de enlace simple entre el carbono y otros elementos. Las longitudes se dan en picómetros (pm).
| H | 106 - 112 | |
| Be | 193 | |
| Mg | 207 | |
| B | 156 | |
| Al | 224 | |
| In | 216 | |
| C | 154 - 120 | |
| Si | 186 | |
| Sn | 214 | |
| Pb | 229 | |
| N | 147 - 210 | |
| P | 187 | |
| As | 198 | |
| Sb | 220 | |
| Bi | 230 | |
| O | 143 - 215 | |
| S | 181 - 255 | |
| Cr | 192 | |
| Se | 198 - 271 | |
| Te | 205 | |
| Mo | 208 | |
| W | 206 | |
| F | 134 | |
| Cl | 176 | |
| Br | 193 | |
| I | 213 | |
| Tabla 1. Distancias de enlace de carbono a otros elementos en picómetros | ||
Longitudes de Enlace en Compuestos Orgánicos
La longitud de enlace real entre dos átomos en una molécula puede variar un poco debido a cómo se organizan los electrones en los enlaces (conocido como hibridación) y a la presencia de otros grupos de átomos cercanos.
Por ejemplo, el enlace carbono-carbono en el diamante mide 154 pm. Esta es la longitud más común para los enlaces simples de carbono. Sin embargo, en algunos compuestos especiales, los enlaces pueden ser más largos o más cortos de lo normal.
- En algunos compuestos con estructuras muy tensas, como ciertos ciclobutabencenos, se han registrado enlaces carbono-carbono de hasta 174 pm. Esto ocurre porque la forma de la molécula "estira" los enlaces.
- También existen enlaces muy cortos. Los alquenos (con enlaces dobles) y los alquinos (con enlaces triples) tienen longitudes de enlace de 134 pm y 120 pm, respectivamente. Esto se debe a la forma en que los electrones se comparten en estos enlaces.
- En el benceno, como mencionamos, todos los enlaces carbono-carbono miden 139 pm, lo que es una longitud intermedia.
Aquí tienes una tabla con longitudes de enlace comunes en compuestos orgánicos:
| Longitudes de enlace en compuestos orgánicos comunes | |||||
|---|---|---|---|---|---|
| C-H | longitud (pm) | C-C | longitud (pm) | Enlaces múltiples | longitud (pm) |
| sp3-H | 110 | sp3-sp3 | 154 | Benceno | 140 |
| sp2-H | 109 | sp3-sp2 | 150 | Alqueno | 134 |
| sp-H | 108 | sp2-sp2 | 135 | Alquino | 120 |
| sp3-sp | 146 | Aleno | 130 | ||
| sp2-sp | 143 | ||||
| sp-sp | 120 | ||||