Ácido fosforoso para niños
Datos para niños
Ácido fosforoso |
||
|---|---|---|
 Modelo 2D del ácido fosforoso
|
||
 Modelo tridimensional
|
||
| Nombre IUPAC | ||
| Ácido fosfónico | ||
| General | ||
| Otros nombres |
Óxido de Dihidroxifosfina |
|
| Fórmula semidesarrollada | H3PO3 | |
| Fórmula estructural | 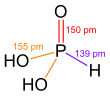 |
|
| Fórmula molecular | H 3PO 3 |
|
| Identificadores | ||
| Número CAS | 13598-36-2 | |
| Número RTECS | SZ6400000 | |
| ChEBI | 44976 | |
| ChEMBL | CHEMBL1235291 | |
| ChemSpider | 10449259 | |
| PubChem | 407 | |
| UNII | C06701 | |
| KEGG | C06701 | |
|
OP(=O)O
|
||
|
InChI
InChI=1S/H3O3P/c1-4(2)3/h4H,(H2,1,2,3)
Key: ABLZXFCXXLZCGV-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Sólido blanco delicuescente | |
| Densidad | 1651 kg/m³; 1,651 g/cm³ | |
| Masa molar | 82 g/mol | |
| Punto de fusión | 73,6 °C (347 K) | |
| Punto de ebullición | Descompone | |
| Propiedades químicas | ||
| Acidez | 1.3, 6.7 pKa | |
| Solubilidad en agua | 310 g/100 mL | |
| Solubilidad | Soluble en alcohol | |
| Peligrosidad | ||
| NFPA 704 |
0
3
1
|
|
| Frases R | R22-35 | |
| Frases S | S26-36/37/39-45 | |
| Riesgos | ||
| Piel | Irritante para la piel | |
| Más información | http://www.sigmaaldrich.com/MSDS/ | |
| Compuestos relacionados | ||
| Ácido fosfórico | H3PO4 (i.e., PO(OH)3) | |
| Ácido hipofosforoso | H3PO2 (i.e., H2PO(OH)) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El ácido fosforoso, también conocido como ácido ortofosforoso, es un compuesto químico con la fórmula H3PO3. Aunque su fórmula tiene tres átomos de hidrógeno, solo dos de ellos pueden separarse fácilmente en una solución para actuar como ácido. Por eso se le llama un ácido diprótico, no triprótico. Este ácido es importante porque se usa para crear otros compuestos que contienen fósforo.
Contenido
¿Qué es el Ácido Fosforoso?
El ácido fosforoso es un ácido que contiene fósforo, oxígeno e hidrógeno. Su fórmula química es H3PO3. Es un sólido blanco que absorbe la humedad del aire.
¿Cómo se llama? (Nomenclatura)
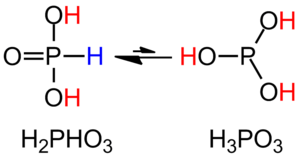
El ácido fosforoso puede existir en dos formas que se transforman una en otra. La forma más común se escribe como HPO(OH)2. Hay otra forma menos común que se escribe como P(OH)3.
La IUPAC, que es la organización que nombra los compuestos químicos, sugiere llamar a la forma HPO(OH)2 como ácido fosfónico. A la forma P(OH)3 la llama ácido fosforoso.
¿Cómo es su estructura?
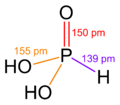
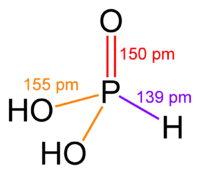
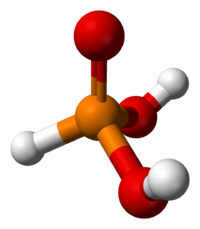
En su estado sólido, el ácido fosforoso (HPO(OH)2) tiene una forma especial. Sus átomos se organizan como un tetraedro. Esto significa que el átomo central de fósforo está unido a otros cuatro átomos, formando una figura de cuatro caras.
Tiene un enlace doble entre el fósforo y un oxígeno (P=O). También tiene dos enlaces simples entre el fósforo y otros oxígenos que están unidos a hidrógenos (P-O(H)).
¿Cómo se obtiene el Ácido Fosforoso?
El ácido fosforoso se puede obtener de varias maneras en la industria.
A partir de óxido de tetrafósforo
Una forma de producirlo es haciendo reaccionar el óxido de tetrafósforo (P4O6) con agua. Esta reacción se llama hidrólisis.
A partir de tricloruro de fósforo
Otra forma común de obtenerlo es haciendo reaccionar el tricloruro de fósforo (PCl3) con agua o vapor. Esta reacción produce ácido fosforoso y ácido clorhídrico.
Después de la reacción, se calienta suavemente la mezcla para que el ácido clorhídrico se evapore. Cuando la solución se enfría por debajo de los 70 °C, el ácido fosforoso se convierte en cristales blancos.
A partir de fosfito de potasio
También se puede obtener a partir de fosfito de potasio (K2HPO3). Para esto, se mezcla el fosfito de potasio con ácido clorhídrico en agua. Luego, se concentra la solución y se le añade alcohol para separar el ácido fosforoso purificado de otras sales.
Propiedades Químicas del Ácido Fosforoso
El ácido fosforoso tiene propiedades interesantes que lo hacen útil en la química.
¿Es un ácido fuerte o débil?
El ácido fosforoso es un ácido diprótico, lo que significa que puede liberar dos protones (iones de hidrógeno) en una solución.
- La primera vez que se disocia, se comporta como un ácido de fuerza media.
- La segunda vez que se disocia, se comporta como un ácido débil.
Esto le permite formar dos tipos de sales: los fosfitos ácidos y los fosfitos neutros. Es importante recordar que el hidrógeno que está directamente unido al átomo de fósforo no se puede separar, a diferencia de lo que ocurre con el ácido fosfórico (H3PO4).
¿Cómo reacciona con otras sustancias?
El ácido fosforoso y sus derivados son buenos agentes reductores. Esto significa que pueden hacer que otras sustancias ganen electrones. Al hacerlo, el ácido fosforoso se oxida y se convierte en ácido fosfórico.
Si se calienta el ácido fosforoso a unos 200 °C, puede transformarse. Una parte se convierte en fosfano (un gas de fósforo e hidrógeno), y otra parte se oxida a ácido fosfórico.
También puede reducir los cationes de algunos metales a sus formas metálicas. Por ejemplo, si se mezcla con cloruro de mercurio(II) en frío, forma un precipitado blanco de cloruro de mercurio(I). Si se añade más ácido fosforoso y se calienta, el cloruro de mercurio(I) se reduce aún más a mercurio metálico.
Usos del Ácido Fosforoso
El ácido fosforoso tiene varias aplicaciones importantes:
- Se usa para producir fosfito de plomo dibásico, que es un material que ayuda a proteger el PVC (un tipo de plástico) y otros polímeros del daño.
- También se utiliza para crear compuestos orgánicos llamados fosfonatos, que son importantes en la química.
- Es un agente reductor fuerte en muchas reacciones químicas.
- Se emplea en la fabricación de fibras sintéticas y en la producción de ciertos pesticidas especiales.
- También se usa para producir el ácido amino-tris-metilenfosfónico (ATMP), que es muy eficaz para tratar el agua.
Galería de imágenes
Véase también
 En inglés: Phosphorous acid Facts for Kids
En inglés: Phosphorous acid Facts for Kids