Nitrato de plomo(II) para niños
Datos para niños
Nitrato de plomo(II) |
||
|---|---|---|
 Nitrato de plomo(II)
|
||
 |
||
| Nombre IUPAC | ||
| bis(trioxidonitrato) de plomo | ||
| General | ||
| Otros nombres | Nitrato de plomo(II) Nitrato plumboso Dinitrato de plomo Plumb dulcis |
|
| Fórmula molecular | Pb(NO3)2 | |
| Identificadores | ||
| Número CAS | 10099-74-8 | |
| Número RTECS | OG2100000 | |
| ChEBI | 37187 | |
| ChemSpider | 21781774 23300, 21781774 | |
| PubChem | 16683880 | |
| UNII | 6E5P1699FI | |
| KEGG | C15234 | |
|
InChI
InChI=InChI=1S/2NO3.Pb/c2*2-1(3)4;/q2*-1;+2
Key: RLJMLMKIBZAXJO-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Sólido blanco inodoro | |
| Densidad | 4530 kg/m³; 4,53 g/cm³ | |
| Masa molar | 331,2 g/mol | |
| Punto de fusión | 563 K (290 °C) | |
| Estructura cristalina | sistema cristalino cúbico | |
| Índice de refracción (nD) | 1,782 | |
| Propiedades químicas | ||
| Solubilidad en agua | 52 g/100 ml (20 °C) | |
| Peligrosidad | ||
| NFPA 704 |
0
3
3
OX
|
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El nitrato de plomo(II) es un compuesto químico que se forma al combinar plomo con ácido nítrico. Se presenta como un cristal sin color o un polvo blanco, y es un oxidante muy fuerte y estable. A diferencia de otras sustancias de plomo, este compuesto se disuelve fácilmente en agua.
Desde hace mucho tiempo, incluso en la Edad Media, se ha usado el nitrato de plomo(II) para crear diferentes pigmentos de colores. Más recientemente, a partir del siglo XX, se utiliza para hacer que materiales como el nailon y los poliésteres sean más resistentes al calor. También se usa en recubrimientos para películas especiales que reaccionan al calor, llamadas fototermográficas.
Es importante saber que el nitrato de plomo(II) es una sustancia que puede ser perjudicial para la salud. Por eso, siempre debe manejarse y guardarse con mucho cuidado y siguiendo las normas de seguridad.
Contenido
Historia del Nitrato de Plomo(II)
Desde la Edad Media, el nitrato de plomo(II) se producía en pequeñas cantidades. Se usaba como base para fabricar pigmentos de colores, como el amarillo cromo o el naranja cromo.
En el siglo XV, un alquimista alemán llamado Andreas Libavius logró crear este compuesto. Lo llamó plumb dulcis, que significa "plomo dulce". Aunque la forma de producirlo es sencilla, no se fabricó en grandes cantidades hasta el siglo XIX en Europa. Fuera de Europa, su producción comercial no comenzó hasta el siglo XX.
¿Cómo funciona el Nitrato de Plomo(II) en la Química?
Cuando el nitrato de plomo se calienta, se descompone. Esto significa que se rompe en otras sustancias, como el óxido de plomo(II), dióxido de nitrógeno y oxígeno. Durante este proceso, a veces se escucha un sonido como un crujido.
Esta característica hace que el nitrato de plomo se use en la pirotecnia, especialmente en los fuegos artificiales.
Nitrato de Plomo en Agua
El nitrato de plomo(II) se disuelve en agua y forma una solución transparente y sin color. Si a esta solución le añades un yoduro soluble, como el yoduro de potasio, se forma una sustancia nueva de color amarillo-anaranjado claro que no se disuelve y cae al fondo. A esto se le llama precipitado.
Esta reacción es un buen ejemplo para mostrar cómo se forman los precipitados en química, porque el cambio de color es muy claro.
El nitrato de plomo(II) es uno de los pocos compuestos de plomo que se disuelven en agua. Esto lo hace muy útil para crear otros compuestos de plomo que no se disuelven, mediante un tipo de reacción química llamada doble descomposición.
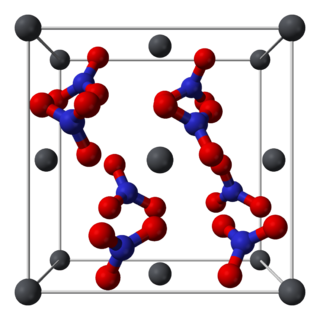
Estructura de los Cristales
El nitrato de plomo(II) sólido tiene una estructura cristalina cúbica. Esto significa que sus átomos están organizados como si formaran pequeños cubos. Los átomos de plomo se encuentran en el centro de las caras de estos cubos.
En esta estructura, cada átomo de plomo está unido a 12 átomos de oxígeno. Los átomos de nitrógeno y oxígeno forman grupos llamados nitratos, que se encuentran a una distancia específica de los átomos de plomo.
¿Cómo se Prepara el Nitrato de Plomo(II)?
Este compuesto se obtiene generalmente disolviendo plomo metálico o óxido de plomo(II) en una solución de ácido nítrico en agua. El nitrato de plomo(II) puede formarse como cristales directamente de esta solución.
Usos del Nitrato de Plomo(II)
A lo largo de la historia, el nitrato de plomo(II) se ha utilizado en la fabricación de fósforos y algunos explosivos especiales. También se ha usado como mordiente (una sustancia que ayuda a fijar los colores) y en la creación de pigmentos para pinturas.
Más recientemente, se ha empleado como estabilizador para el nailon y los poliésteres, y como recubrimiento en películas fototermográficas. También se ha usado en productos para controlar roedores.
En los laboratorios, el nitrato de plomo(II) es una buena fuente para obtener tetróxido de dinitrógeno puro. Cuando se calienta con cuidado, produce óxido de nitrógeno(IV) y oxígeno, que luego se pueden purificar.
Seguridad al Usar Nitrato de Plomo(II)
El nitrato de plomo(II) es una sustancia que debe manejarse con mucho cuidado. Es perjudicial para la salud, especialmente si se ingiere. La exposición a esta sustancia puede causar problemas digestivos, dolores de estómago, pérdida de apetito y calambres. Si una persona se expone por mucho tiempo, puede afectar el sistema nervioso y los riñones.
El plomo es un veneno que se acumula lentamente en el cuerpo, principalmente en los huesos, y tarda mucho tiempo en eliminarse.
Los niños son más sensibles al plomo que los adultos, ya que sus cuerpos lo absorben más fácilmente. La exposición al plomo durante el desarrollo puede afectar el crecimiento y la salud de los niños. Por estas razones, es muy importante que los niños y las personas en etapas de desarrollo no estén expuestos a compuestos de plomo que se disuelven en agua. En muchos países, esto es una ley.
Organizaciones como el Centro Internacional de Investigación del Cáncer (CIRC) han clasificado los compuestos de plomo como sustancias que podrían aumentar el riesgo de ciertos problemas de salud graves en humanos.
Para manipular nitrato de plomo(II), siempre se deben tomar precauciones. Esto incluye usar equipo de protección como gafas de seguridad y guantes. Los experimentos con esta sustancia deben hacerse en lugares con buena ventilación, como campanas extractoras, y los residuos no deben ser liberados al ambiente.
Véase también
 En inglés: Lead nitrate Facts for Kids
En inglés: Lead nitrate Facts for Kids
- Cerusa veneciana
- Amarillo de Nápoles
- Plomo rojo