Bicapa lipídica para niños
La bicapa lipídica es como una pared muy delgada y flexible que rodea a las células y a sus partes internas. Imagina que es una lámina doble hecha de pequeñas moléculas llamadas lípidos. Esta barrera es esencial porque mantiene todo lo que la célula necesita dentro, como iones y proteínas, y evita que se dispersen.
Las bicapas son increíblemente delgadas, miden solo unos pocos nanómetros de grosor. Son como una barrera impermeable para la mayoría de las moléculas que se disuelven fácilmente en agua (llamadas hidrofílicas) y para los iones. Esto es muy importante porque permite a las células controlar la cantidad de sal y el pH (qué tan ácida o básica es una sustancia) dentro de ellas. Lo hacen usando proteínas especiales en la membrana, como "bombas" o "canales" que mueven los iones.
Las bicapas de las células están hechas principalmente de fosfolípidos. Estas moléculas son muy especiales porque tienen dos partes: una "cabeza" que le gusta el agua (hidrofílica) y dos "colas" que le temen al agua (hidrofóbicas), hechas de cadenas de ácidos grasos. Las cabezas de los fosfolípidos pueden tener diferentes grupos químicos que cambian la superficie de la bicapa y actúan como "señales" para otras moléculas.
Las colas de los lípidos también influyen en cómo se comporta la membrana. A bajas temperaturas, la bicapa puede ser más rígida, como un gel. Pero a temperaturas más altas, se vuelve más fluida, como un líquido. Las características químicas de las colas de los lípidos determinan a qué temperatura ocurre este cambio. La forma en que los lípidos se organizan en la bicapa también afecta su resistencia, por ejemplo, qué tan bien soporta estirarse o doblarse.
Además de los fosfolípidos, las membranas biológicas tienen otras moléculas. En las células animales, el colesterol es muy importante. Ayuda a que la bicapa sea más fuerte, menos permeable (es decir, que menos cosas puedan pasar a través de ella) y regula la actividad de algunas proteínas que están incrustadas en la membrana. Estas proteínas son cruciales para que la célula se comunique con su entorno y con otras células.
Estudiar las bicapas lipídicas es un desafío porque son muy frágiles e invisibles con un microscopio normal. Por eso, los científicos usan técnicas avanzadas como la microscopía electrónica y la microscopía de fuerza atómica.
Contenido
- Estructura y organización de la bicapa lipídica
- Funciones biológicas de la bicapa lipídica
- Métodos para estudiar las bicapas
- Transporte a través de la bicapa
- Mecánica de la bicapa
- Fusión de bicapas
- Sistemas modelo para estudiar la bicapa
- Aplicaciones comerciales de las bicapas lipídicas
- Historia de la bicapa lipídica
- Galería de imágenes
- Véase también
Estructura y organización de la bicapa lipídica
Cuando los fosfolípidos se encuentran con el agua, se organizan solos en una lámina de dos capas. Las colas hidrofóbicas (las que no les gusta el agua) se agrupan hacia el centro de la lámina, lejos del agua. Esta organización crea dos "hojas" o capas moleculares individuales. El centro de esta bicapa casi no tiene agua y no permite el paso de moléculas como azúcares o sales que se disuelven en agua.
Este proceso de auto-organización ocurre porque las moléculas hidrofóbicas "prefieren" estar juntas para que las moléculas de agua puedan unirse más libremente entre sí, lo que aumenta el desorden natural del sistema (conocido como entropía). En este proceso complejo, hay interacciones débiles entre las moléculas, como las fuerzas de Van der Waals, enlaces electrostáticos y puentes de hidrógeno.
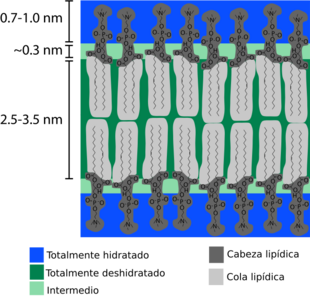
¿Cómo se ve la bicapa en sección transversal?
La bicapa lipídica es extremadamente delgada. Si una célula de mamífero típica (de unos 10 micrómetros de diámetro) fuera tan grande como una sandía, su membrana plasmática sería tan delgada como una hoja de papel. Aunque solo mide unos pocos nanómetros de grosor, la bicapa tiene diferentes regiones químicas a lo largo de su sección transversal. Los científicos estudian estas regiones y cómo interactúan con el agua usando técnicas como la reflectometría de rayos X y la dispersión de neutrones.
La primera región, en ambos lados de la bicapa, es la de los grupos de cabeza hidrofílicos. Esta parte está completamente rodeada de agua y mide aproximadamente 0.8-0.9 nanómetros de grosor. En las bicapas de fosfolípidos, el grupo fosfato se encuentra en esta región hidratada. A veces, esta región puede ser mucho más grande si hay una proteína o una cadena larga de azúcar unida a la cabeza. Por ejemplo, algunas bacterias tienen una capa de lipopolisacáridos en su membrana externa que ayuda a retener agua y evitar que se deshidraten.
Junto a la región hidratada, hay una zona intermedia que está parcialmente hidratada, de unos 0.3 nanómetros de grosor. En esta pequeña distancia, la cantidad de agua disminuye drásticamente.
La región central de la bicapa, que es hidrofóbica, suele tener entre 3 y 4 nanómetros de grosor. Este valor puede variar según el largo y la composición química de las colas de los lípidos, y también cambia significativamente con la temperatura, especialmente durante una transición de fase.
¿Por qué las capas de la bicapa son diferentes?
La mayoría de las bicapas naturales tienen composiciones diferentes en sus capas interna y externa. Por ejemplo, en las células rojas de la sangre humana, la capa interna (hacia el interior de la célula) tiene principalmente fosfatidiletanolamina y fosfatidilserina. En cambio, la capa externa (hacia el exterior de la célula) está compuesta por fosfatidilcolina y esfingomielina.
Esta diferencia se debe a cómo se forman los lípidos en la célula. Algunas enzimas llamadas flipasas transportan lípidos de la capa interna a la externa. Otros lípidos se forman directamente en la capa externa. Esta diferencia en la composición es importante para varias funciones biológicas. Por ejemplo, cuando una célula está a punto de morir de forma programada, la fosfatidilserina se mueve a la superficie externa, lo que es una señal para que otras células la eliminen.
Fases y cambios de estado de la bicapa
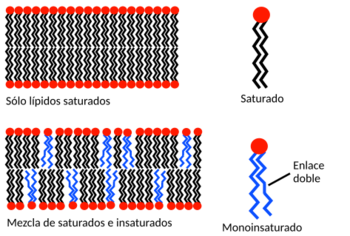
A una temperatura específica, una bicapa lipídica puede estar en estado líquido o en estado de gel (más sólido). Cada tipo de lípido tiene una temperatura a la que cambia de gel a líquido. En ambos estados, las moléculas de lípidos no pueden pasar fácilmente de una capa a otra de la bicapa. Sin embargo, en las bicapas líquidas, un lípido puede intercambiar su lugar con un vecino millones de veces por segundo. Este movimiento aleatorio permite que los lípidos se muevan y se dispersen por la superficie de la membrana. En contraste, en una bicapa en fase de gel, los lípidos están fijos en su lugar.
El comportamiento de las fases de las bicapas lipídicas depende mucho de las fuerzas de atracción entre las moléculas de lípidos cercanas. Los lípidos con colas más largas tienen más superficie para interactuar, lo que aumenta la fuerza de atracción y disminuye la movilidad de los lípidos. Por eso, un lípido con cola corta será más fluido que uno idéntico con cola larga a la misma temperatura.
La temperatura a la que ocurre el cambio de fase también se ve afectada por el grado de insaturación de las colas de los lípidos. Un doble enlace en la cadena de alcano puede crear una curvatura, lo que altera el empaque de los lípidos. Esta interrupción crea más espacio libre dentro de la bicapa, permitiendo mayor flexibilidad en las cadenas cercanas. Un ejemplo de esto en la vida diaria es la mantequilla, que tiene muchas grasas saturadas y es sólida a temperatura ambiente, mientras que el aceite vegetal, que es principalmente insaturado, es líquido.
La mayoría de las membranas naturales son una mezcla compleja de diferentes moléculas de lípidos. Si algunos componentes están en fase líquida y otros en fase de gel a una temperatura dada, las dos fases pueden coexistir en regiones separadas, como un iceberg flotando en el océano. Esta separación de fases es muy importante en la biología porque los componentes de la membrana, como las proteínas, pueden concentrarse en una fase u otra, lo que afecta su actividad. El colesterol es un componente clave en muchos sistemas de fase mixta, ya que regula la permeabilidad de la bicapa, su resistencia y las interacciones bioquímicas.
Química de la superficie de la bicapa
Mientras que las colas de los lípidos controlan principalmente el comportamiento de fase de la bicapa, el grupo de cabeza es el que determina la química de su superficie. La mayoría de las bicapas naturales están compuestas principalmente por fosfolípidos, aunque los esfingolípidos (como la esfingomielina) y los esteroles (como el colesterol) también son componentes importantes. El grupo de cabeza más común en los fosfolípidos es la fosfatidilcolina (PC), que constituye aproximadamente la mitad de los fosfolípidos en la mayoría de las células de mamíferos. La PC tiene una carga negativa en el grupo fosfato y una carga positiva en la amina, pero en general no tiene carga neta.
Otros grupos de cabeza, como la fosfatidilserina (PS) y la fosfatidiletanolamina (PE), también están presentes en diferentes cantidades y pueden tener funciones biológicas específicas. Por ejemplo, la presencia de PS en la superficie externa de los glóbulos rojos es una señal de que la célula está muriendo. A diferencia de la PC, algunos de estos otros grupos de cabeza tienen una carga neta, lo que puede cambiar cómo interactúan las moléculas pequeñas con la bicapa.
Funciones biológicas de la bicapa lipídica
Contención y separación
La función principal de la bicapa lipídica en la biología es separar los compartimentos acuosos de su entorno. Sin esta barrera, sería difícil definir lo que es una célula o un organismo. Esta barrera es una bicapa lipídica en todas las formas de vida conocidas, excepto en algunas arqueas que usan una monocapa lipídica especial. Incluso se cree que las primeras formas de vida pudieron haber sido simples vesículas lipídicas. La capacidad de la bicapa lipídica para separar cosas se basa en que las moléculas que les gusta el agua no pueden cruzar fácilmente el centro hidrofóbico de la bicapa.
El núcleo, las mitocondrias y los cloroplastos tienen dos bicapas lipídicas, mientras que otras partes de la célula están rodeadas por una sola bicapa (como la membrana plasmática, el retículo endoplasmático, el aparato de Golgi y los lisosomas).
Los procariontes (como las bacterias) solo tienen una bicapa lipídica: la membrana celular. Muchos procariontes también tienen una pared celular, pero esta está hecha de proteínas o carbohidratos, no de lípidos. En contraste, los eucariontes (como las células de plantas y animales) tienen muchos orgánulos rodeados por una o más bicapas lipídicas. En las células del hígado, por ejemplo, la membrana plasmática representa solo el dos por ciento de la superficie total de la bicapa de la célula, mientras que el retículo endoplasmático tiene más del cincuenta por ciento y las mitocondrias un treinta por ciento más.
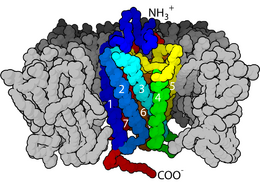
Señalización y comunicación celular
Las bicapas lipídicas también son importantes para la comunicación celular, ya que son el hogar de muchas proteínas que atraviesan la membrana. Estas proteínas son una clase muy grande e importante de biomoléculas. Se estima que hasta un tercio de las proteínas humanas pueden ser proteínas de membrana.
Algunas de estas proteínas están unidas a la parte exterior de la membrana celular. Un ejemplo es la proteína CD59, que identifica a las células como "propias" y evita que el sistema inmune las destruya. Otros virus, como el VIH, evaden el sistema inmune al incorporar estas proteínas de la célula huésped en su propia superficie.
Otras proteínas de membrana atraviesan completamente la bicapa y sirven para transmitir señales desde el exterior al interior de la célula. La clase más común de estas proteínas son los receptor acoplado a proteínas G (GPCR). Los GPCR son responsables de gran parte de la capacidad de la célula para sentir su entorno. Debido a esta función vital, aproximadamente el 40% de todos los medicamentos modernos están dirigidos a los GPCR.
Además de las proteínas, las bicapas lipídicas también pueden participar directamente en la señalización. Un ejemplo clásico es la señal de fosfatidilserina durante la muerte celular programada. Normalmente, la fosfatidilserina se encuentra solo en el lado interno de la membrana celular. Pero cuando una célula está muriendo, una proteína hace que esta fosfatidilserina se mueva a la superficie externa de la bicapa. La presencia de fosfatidilserina en el exterior activa un proceso llamado fagocitosis, que elimina las células muertas o moribundas.
Métodos para estudiar las bicapas
Estudiar la bicapa lipídica es difícil porque es muy delgada y frágil. Sin embargo, en los últimos setenta años se han desarrollado muchas técnicas para investigar su estructura y función.
Las mediciones eléctricas son una forma directa de entender una función importante de la bicapa: su capacidad para separar y evitar el flujo de iones. Al aplicar un voltaje a través de la bicapa y medir la corriente resultante, se puede determinar la resistencia de la bicapa. Esta resistencia suele ser muy alta, ya que el centro hidrofóbico es impermeable a las partículas cargadas. La presencia de incluso unos pocos agujeros muy pequeños aumenta drásticamente la corriente. Este sistema es tan sensible que incluso se puede observar la actividad de canales de iones individuales.
Las mediciones eléctricas no proporcionan una imagen real como lo hace un microscopio. Las bicapas lipídicas no se pueden ver con un microscopio tradicional porque son demasiado delgadas. Para observarlas, los investigadores suelen usar microscopía de fluorescencia. En esta técnica, se usa un tinte que se une a las moléculas deseadas en la bicapa y que emite luz cuando se le ilumina. La resolución suele ser de unos pocos cientos de nanómetros, mucho más pequeña que una célula, pero mucho más grande que el grosor de una bicapa lipídica.
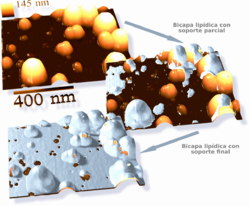
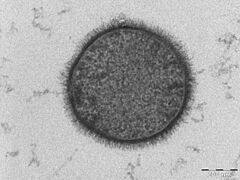
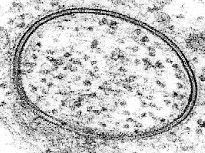
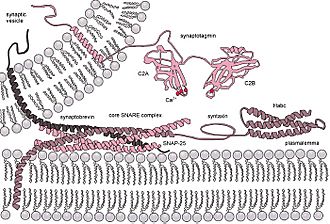
La microscopía electrónica ofrece una imagen de mayor resolución. En un microscopio electrónico, un haz de electrones enfocados interactúa con la muestra en lugar de un haz de luz. Combinada con técnicas de congelación rápida, la microscopía electrónica se ha usado para estudiar cómo se transportan las sustancias dentro y entre las células, por ejemplo, mostrando que las vesículas son el medio de liberación química en las sinapsis.
La espectroscopia de resonancia magnética nuclear (31P-NMR) se usa mucho para estudiar las bicapas de fosfolípidos y las membranas biológicas en sus condiciones naturales. Este análisis puede dar mucha información sobre cómo se empaquetan los lípidos, los cambios de fase (gel, líquido, etc.), la orientación y el movimiento de los grupos de cabeza de los lípidos, y las propiedades elásticas de la bicapa.
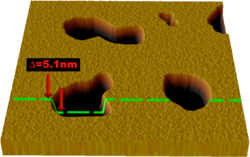
Un método más reciente para estudiar las bicapas lipídicas es la microscopía de fuerza atómica (AFM). En lugar de usar luz o partículas, una pequeña punta afilada "escanea" la superficie al hacer contacto físico con la bicapa y moverse sobre ella, como una aguja de tocadiscos. La AFM es una técnica prometedora porque puede obtener imágenes con resolución nanométrica a temperatura ambiente e incluso bajo agua o soluciones fisiológicas, que son las condiciones necesarias para el comportamiento natural de la bicapa. Con esta capacidad, la AFM se ha usado para examinar el comportamiento dinámico de la bicapa, incluyendo la formación de poros (agujeros) y los cambios de fase. Otra ventaja es que la AFM no necesita que los lípidos tengan una etiqueta fluorescente o isotópica, ya que la punta de la sonda interactúa mecánicamente con la superficie de la bicapa. Por esto, la misma imagen puede mostrar tanto los lípidos como las proteínas asociadas, a veces incluso con una resolución de una sola molécula. La AFM también puede investigar las propiedades mecánicas naturales de las bicapas lipídicas.
Las bicapas lipídicas muestran altos niveles de birrefringencia, lo que significa que el índice de refracción en el plano de la bicapa es diferente del perpendicular. Esto se ha usado para caracterizar el grado de orden y desorden en las bicapas, usando interferometría de polarización dual para entender cómo interactúan las proteínas.
Las bicapas lipídicas son sistemas moleculares complejos con muchos grados de libertad. Por lo tanto, simular la membrana a nivel atómico y calcular sus propiedades es difícil y requiere mucha capacidad de cálculo. Recientemente, se han realizado cálculos de química cuántica para estimar los momentos dipolares y cuadrupolares de las membranas lipídicas.
Transporte a través de la bicapa
Difusión pasiva
La mayoría de las moléculas polares no se disuelven bien en el centro de hidrocarburo de una bicapa lipídica. Por eso, tienen una baja capacidad para atravesar la bicapa. Este efecto es aún más notorio para las partículas cargadas, que tienen una capacidad de paso aún menor que las moléculas polares neutras. Los aniones (iones con carga negativa) suelen difundirse mejor a través de las bicapas que los cationes (iones con carga positiva).
En comparación con los iones, las moléculas de agua tienen una capacidad relativamente alta para atravesar la bicapa, lo que se ve en el hinchamiento osmótico. Cuando una célula o vesícula con una alta concentración de sal en su interior se coloca en una solución con baja concentración de sal, se hinchará y, finalmente, explotará. Esto no ocurriría si el agua no pudiera pasar a través de la bicapa con relativa facilidad. La razón por la que el agua tiene una permeabilidad tan alta a través de las bicapas aún no se comprende completamente y sigue siendo un tema de debate.
Las moléculas pequeñas, sin carga y no polares, se difunden a través de las bicapas lipídicas mucho más rápido que los iones o el agua. Esto incluye grasas y disolventes orgánicos como el cloroformo y el éter. Sin importar su polaridad, las moléculas más grandes se difunden más lentamente a través de las bicapas lipídicas que las moléculas pequeñas.
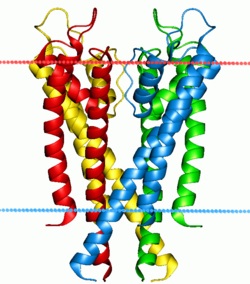
Bombas y canales de iones
Existen dos tipos especiales de proteínas que manejan los gradientes de iones a través de las membranas celulares y subcelulares: los canales iónicos y las bombas de iones. Ambas son proteínas que atraviesan la bicapa, pero sus funciones son muy diferentes. Las bombas de iones son proteínas que crean y mantienen gradientes químicos. Usan una fuente de energía externa para mover iones en contra de su gradiente de concentración, hacia un área de mayor potencial químico. La fuente de energía puede ser ATP, como en el caso de la bomba de sodio-potasio. O puede ser otro gradiente químico ya existente. Gracias a las bombas de iones, las células pueden regular su pH bombeando protones.
A diferencia de las bombas de iones, los canales iónicos no crean gradientes químicos. En cambio, los usan para realizar un trabajo o enviar una señal. El ejemplo más conocido es el canal de sodio dependiente de voltaje, que permite la transmisión del potencial de acción a lo largo de las neuronas. Todos los canales iónicos tienen algún tipo de mecanismo de "apertura y cierre". En el ejemplo anterior, era la polarización eléctrica, pero otros canales pueden activarse por la unión de una molécula o por un cambio en la forma de otra proteína cercana.
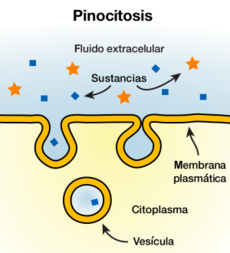
Endocitosis y exocitosis
Algunas moléculas o partículas son demasiado grandes o demasiado afines al agua para pasar a través de una bicapa lipídica. Otras moléculas podrían pasar, pero necesitan ser transportadas tan rápidamente y en tanta cantidad que el transporte por canales no es práctico. En estos casos, estas sustancias pueden moverse a través de la membrana celular mediante la fusión o la formación de vesículas.
Cuando una vesícula se forma dentro de la célula y se fusiona con la membrana plasmática para liberar su contenido al exterior, este proceso se llama exocitosis. En el proceso inverso, una parte de la membrana celular se curva hacia adentro y finalmente se cierra, encerrando una porción del líquido exterior para transportarlo al interior de la célula. Esto se llama endocitosis.
La endocitosis y la exocitosis dependen de mecanismos moleculares muy diferentes, pero están estrechamente relacionados y no podrían funcionar el uno sin el otro. La razón principal de esta interdependencia es la gran cantidad de material lipídico involucrado. En una célula típica, el área de la bicapa equivalente a toda la membrana plasmática pasa por el ciclo de endocitosis/exocitosis en aproximadamente media hora. Si estos dos procesos no estuvieran equilibrados, la célula se hincharía demasiado o se quedaría sin membrana plasmática en cuestión de minutos.
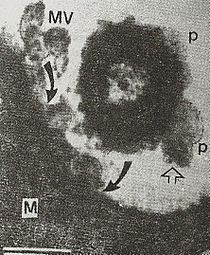
Exocitosis en procariontes: La exocitosis de vesículas de membrana, conocida como tráfico de vesículas de membrana, se consideraba tradicionalmente exclusiva de las células eucariontes. Sin embargo, se descubrió que las nanovesículas, conocidas como vesículas de membrana externa bacteriana, liberadas por microorganismos gramnegativos, transportan moléculas de señal bacterianas para interactuar con las células huésped o con el entorno, por ejemplo, en la entrada a la célula huésped y en las interacciones microbio-ambiente en general.
Electroporación
La electroporación es un aumento rápido de la permeabilidad en la bicapa causado por la aplicación de un campo eléctrico fuerte a través de la membrana. Experimentalmente, la electroporación se usa para introducir moléculas que les gusta el agua en las células. Es una técnica muy útil para moléculas grandes y muy cargadas como el ADN, que nunca se difundirían pasivamente a través del centro hidrofóbico de la bicapa. Por eso, la electroporación es uno de los principales métodos para introducir material genético en las células. Incluso se ha sugerido que la electroporación causada por tormentas eléctricas podría ser un mecanismo natural de transferencia horizontal de genes (intercambio de genes entre organismos sin reproducción).
Este aumento de la permeabilidad afecta principalmente el transporte de iones y otras sustancias hidratadas, lo que indica que el mecanismo es la creación de agujeros llenos de agua a escala nanométrica en la membrana. Aunque la electroporación y la ruptura dieléctrica (otro fenómeno eléctrico) resultan de la aplicación de un campo eléctrico, los mecanismos son fundamentalmente diferentes. En la ruptura dieléctrica, el material de la barrera se ioniza, creando un camino conductor. La alteración del material es de naturaleza química. En contraste, durante la electroporación, las moléculas de lípidos no se alteran químicamente, sino que simplemente cambian de posición, abriendo un poro que actúa como vía conductora a través de la bicapa, ya que se llena de agua.
Mecánica de la bicapa

Las bicapas lipídicas son estructuras lo suficientemente grandes como para tener algunas propiedades mecánicas de líquidos o sólidos. Se pueden describir usando el módulo de compresión de área (Ka), el módulo de flexión (Kb) y la energía de borde (Λ). Las bicapas lipídicas sólidas también tienen un módulo de corte, pero al igual que cualquier líquido, el módulo de corte es cero para las bicapas fluidas. Estas propiedades mecánicas afectan el funcionamiento de la membrana. Ka y Kb influyen en la capacidad de las proteínas y moléculas pequeñas para insertarse en la bicapa, y se ha demostrado que las propiedades mecánicas de la bicapa alteran la función de los canales iónicos que se activan mecánicamente. Las propiedades mecánicas de la bicapa también determinan qué tipo de estrés puede soportar una célula sin romperse. Aunque las bicapas lipídicas pueden doblarse fácilmente, la mayoría no puede estirarse más que un pequeño porcentaje antes de romperse.
Como se mencionó en la sección "Estructura y organización", la atracción hidrofóbica de las colas de los lípidos en el agua es la fuerza principal que mantiene unidas las bicapas lipídicas. Por lo tanto, la elasticidad de la bicapa está determinada principalmente por la cantidad de área adicional que se expone al agua cuando las moléculas de lípidos se estiran. No es sorprendente que los estudios hayan demostrado que el Ka varía mucho con la presión osmótica, pero poco con el largo de la cola y la insaturación. Debido a que las fuerzas involucradas son tan pequeñas, es difícil determinar experimentalmente el Ka. La mayoría de las técnicas de microscopía requieren equipos sofisticados y muy sensibles.
A diferencia de Ka, que mide la energía necesaria para estirar la bicapa, Kb mide la energía necesaria para doblar o flexionar la bicapa. Formalmente, un módulo de flexión se define como la energía necesaria para deformar una membrana de su curvatura natural a otra curvatura. La curvatura natural se define por la relación entre el diámetro del grupo de cabeza y el del grupo de cola. Para los lípidos con dos colas, esta relación es casi uno, por lo que la curvatura natural es casi cero. Si un lípido particular tiene una desviación demasiado grande de la curvatura natural, no formará una bicapa y en su lugar formará otras estructuras como micelas. La adición de moléculas pequeñas que les gusta el agua, como la sacarosa, a liposomas laminares de lípidos mixtos desestabiliza las bicapas hacia una fase micelar. Típicamente, Kb no se mide experimentalmente, sino que se calcula a partir de las mediciones de Ka y el grosor de la bicapa, ya que los tres parámetros están relacionados.
Λ es una medida de la energía necesaria para exponer un borde de la bicapa al agua, ya sea rasgando la bicapa o creando un agujero en ella. El origen de esta energía es el hecho de que, al crear tal interfaz, se exponen algunas de las colas de los lípidos al agua, pero la orientación exacta de estos lípidos del borde es desconocida. Existe alguna evidencia de que pueden coexistir poros hidrofóbicos (colas rectas) e hidrofílicos (cabezas curvadas alrededor).
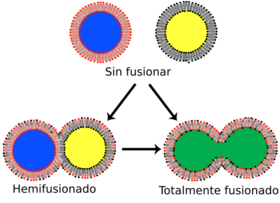
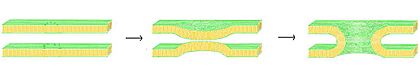
Fusión de bicapas
La fusión es el proceso por el cual dos bicapas lipídicas se unen, formando una estructura conectada. Si esta fusión ocurre completamente a través de ambas capas de ambas bicapas, se forma un puente lleno de agua y las soluciones contenidas por las bicapas pueden mezclarse. Alternativamente, si solo una capa de cada bicapa participa en el proceso de fusión, se dice que las bicapas están "hemifusionadas". La fusión está involucrada en muchos procesos celulares, especialmente en eucariontes, ya que la célula eucariota está ampliamente dividida por bicapas lipídicas de membrana. La exocitosis, la unión de células para crear una nueva vida y el transporte de productos de desecho al lisosoma son algunos de los muchos procesos eucariontes que dependen de alguna forma de fusión. Incluso la entrada de patógenos puede ser controlada por la fusión, ya que muchos virus cubiertos por una bicapa tienen proteínas de fusión dedicadas para poder entrar en la célula huésped.
Hay cuatro pasos fundamentales en el proceso de fusión. Primero, las membranas involucradas deben acercarse mucho, a pocos nanómetros de distancia. Segundo, las dos bicapas deben entrar en contacto muy cercano (a pocos angstroms). Para lograr este contacto, las dos superficies deben deshidratarse al menos parcialmente, ya que el agua de la superficie límite normalmente presente hace que las bicapas se repelan fuertemente. La presencia de iones, especialmente cationes divalentes como el magnesio y el calcio, afecta fuertemente este paso. Uno de los papeles críticos del calcio en el cuerpo es la regulación de la fusión de membranas. Tercero, debe formarse una desestabilización en un punto entre las dos bicapas, distorsionando sus estructuras. La naturaleza exacta de esta distorsión no se conoce. Una teoría es que debe formarse un "tallo" muy curvado entre las dos bicapas. Los defensores de esta teoría creen que explica por qué la fosfatidiletanolamina, un lípido muy curvado, promueve la fusión. Finalmente, en la última etapa de la fusión, este defecto puntual crece y los componentes de las dos bicapas se mezclan y se difunden lejos del sitio de contacto.
La situación se complica aún más cuando se considera la fusión en organismos vivos, ya que la fusión biológica casi siempre está regulada por la acción de proteínas asociadas a la membrana. Las primeras de estas proteínas en ser estudiadas fueron las proteínas de fusión virales, que permiten que un virus con envoltura inserte su material genético en la célula huésped (los virus envueltos son aquellos rodeados por una bicapa lipídica, y algunos otros solo tienen una capa de proteína). Las células eucariontes también usan proteínas de fusión; las mejor estudiadas son las proteínas SNARE, que se usan para dirigir todo el tráfico de vesículas dentro de la célula. A pesar de años de estudio, aún queda mucho por descubrir sobre la función de esta clase de proteínas. De hecho, todavía hay un debate activo sobre si las SNAREs están relacionadas con el acoplamiento temprano o participan más tarde en el proceso de fusión, facilitando la hemifusión.
En los estudios de biología molecular y celular, a menudo es deseable inducir artificialmente la fusión. La adición de polietilenglicol (PEG) provoca la fusión sin una agregación significativa o interrupción bioquímica. Este procedimiento se usa ahora ampliamente, por ejemplo, fusionando células B con células de melanoma. El "hibridismo" resultante de esta combinación expresa un anticuerpo deseado, pero se vuelve "inmortal" debido al componente de melanoma. La fusión también puede inducirse artificialmente mediante electroporación en un proceso conocido como electrofusión. Se cree que este fenómeno resulta de los bordes con energía activa formados durante la electroporación, que pueden actuar como el punto de defecto local para iniciar el crecimiento del tallo entre dos bicapas.
Sistemas modelo para estudiar la bicapa
Las bicapas lipídicas pueden crearse artificialmente en el laboratorio para que los investigadores realicen experimentos que no se pueden hacer en bicapas naturales. Existen muchos tipos de bicapas modelo, cada una con ventajas y desventajas experimentales. Se pueden hacer con lípidos sintéticos o lípidos naturales. Entre los sistemas modelo más comunes se encuentran:
- Membranas lipídicas negras
- Capas lipídicas soportadas
- Membranas de bicapas lipídicas ancladas (tBLM)
- Vesículas
Aplicaciones comerciales de las bicapas lipídicas
Hasta la fecha, la aplicación comercial más exitosa de las bicapas lipídicas ha sido el uso de liposomas para la administración de medicamentos, especialmente para el tratamiento de enfermedades como el cáncer. (Nota: el término "liposoma" es esencialmente sinónimo de "vesícula", excepto que "vesícula" es un término general para la estructura, mientras que "liposomas" se refiere solo a vesículas artificiales, no naturales). La idea básica de la administración de medicamentos liposomales es que el medicamento se encapsula en solución dentro del liposoma y luego se inyecta en el paciente. Estos liposomas cargados con el medicamento viajan por el cuerpo hasta que se unen en el lugar deseado y se rompen, liberando el medicamento. En teoría, los liposomas deberían ser un sistema ideal para administrar medicamentos, ya que pueden aislar casi cualquier medicamento que le guste el agua, pueden ser modificados para dirigirse a tejidos específicos y pueden ser relativamente no tóxicos, ya que el cuerpo tiene formas de descomponer los lípidos.
La primera generación de liposomas para la administración de medicamentos tenía una composición lipídica simple y presentaba varias limitaciones. Su circulación en el torrente sanguíneo era muy limitada debido a la eliminación por los riñones y la fagocitosis (proceso en el que las células "comen" partículas). El perfeccionamiento de la composición de los lípidos para ajustar la fluidez, la carga superficial y la hidratación de la superficie dio como resultado vesículas que absorbían menos proteínas del suero y, por lo tanto, eran menos fácilmente reconocidas por el sistema inmune. El avance más significativo en esta área fue la unión de polietilenglicol (PEG) a la superficie del liposoma para producir vesículas "ocultas", que circulan durante mucho tiempo sin ser eliminadas por el sistema inmune o los riñones.
Los primeros liposomas ocultos se dirigían pasivamente a los tejidos tumorales. Debido a que los tumores inducen un crecimiento rápido y descontrolado de vasos sanguíneos, son especialmente "permeables" y permiten que los liposomas salgan de la sangre a un ritmo mucho mayor que el tejido normal. Más recientemente, se ha trabajado en la unión de anticuerpos u otros marcadores moleculares a la superficie del liposoma con la esperanza de que se unan activamente a un tipo de célula o tejido específico. Algunos ejemplos de este enfoque ya están en ensayos clínicos.
Otra aplicación potencial de las bicapas lipídicas es en el campo de los biosensores. Dado que la bicapa lipídica no solo es la barrera entre el interior y el exterior de la célula, sino que también es el lugar de una extensa transmisión de señales. Los investigadores han intentado aprovechar este potencial para desarrollar un dispositivo basado en la bicapa para el diagnóstico clínico. El progreso ha sido lento en esta área y, aunque algunas empresas han desarrollado sistemas de detección automatizados basados en lípidos, están dirigidos a la comunidad de investigación. Estos incluyen Biacore (ahora GE Healthcare Life Sciences), que ofrece un chip desechable para usar bicapas lipídicas en estudios de cinética de unión, y Nanion Inc., que ha desarrollado un sistema automatizado de "patch clamp". También se están buscando otras aplicaciones más inusuales, como el uso de poros de la membrana bicapa lipídica para la secuenciación de ADN por Oxford Nanolabs. Hasta la fecha, esta tecnología no ha demostrado ser comercialmente viable.
Una bicapa lipídica soportada (SLB), como se describió anteriormente, ha logrado éxito comercial como técnica de cribado para medir la permeabilidad de los medicamentos. Este ensayo de permeabilidad de membrana artificial paralela (PAMPA) mide la permeabilidad a través de una mezcla de lípidos formulada específicamente, donde se ha encontrado una alta correlación con cultivos celulares, el tracto gastrointestinal, la barrera hematoencefálica y la piel.
Historia de la bicapa lipídica
A principios del siglo XX, los científicos creían que las células estaban rodeadas por una barrera delgada similar al aceite, pero no se conocía la naturaleza estructural de esta membrana. Dos experimentos en 1925 sentaron las bases para llenar este vacío. Midiendo la capacitancia de soluciones de glóbulos rojos, Hugo Fricke determinó que la membrana celular tenía 3.3 nanómetros de grosor.
Aunque los resultados de este experimento fueron precisos, Fricke interpretó mal los datos, pensando que la membrana celular era una sola capa molecular. El profesor Dr. Evert Gorter (1881–1954) y F. Grendel de la Universidad de Leiden abordaron el problema desde una perspectiva diferente, extendiendo los lípidos de los glóbulos rojos como una monocapa sobre una cubeta de Langmuir-Blodgett. Cuando compararon el área de la monocapa con el área de la superficie de las células, encontraron una relación de dos a uno. Análisis posteriores mostraron varios errores y suposiciones incorrectas en este experimento, pero, casualmente, estos errores se anularon entre sí y, a partir de estos datos imperfectos, Gorter y Grendel llegaron a la conclusión correcta: que la membrana celular es una bicapa lipídica.
Esta teoría se confirmó mediante el uso de microscopía electrónica a finales de la década de 1950. Aunque no publicó el primer estudio de microscopía electrónica de bicapas lipídicas, J. David Robertson fue el primero en afirmar que las dos bandas oscuras de alta densidad de electrones eran los grupos de cabeza y las proteínas asociadas de dos monocapas de lípidos opuestas. En este trabajo, Robertson propuso el concepto de la "unidad de membrana". Esta fue la primera vez que la estructura de bicapa se asignó universalmente a todas las membranas celulares, así como a las membranas de los orgánulos.
Casi al mismo tiempo, el desarrollo de membranas modelo confirmó que la bicapa lipídica es una estructura estable que puede existir independientemente de las proteínas. Al "pintar" una solución de lípidos en un disolvente orgánico a través de una abertura, Mueller y Rudin pudieron crear una bicapa artificial y determinar que esta exhibía fluidez lateral, alta resistencia eléctrica y la capacidad de repararse a sí misma en respuesta a una perforación, todas las cuales son propiedades de una membrana celular natural. Unos años más tarde, Alec Bangham demostró que las bicapas, en forma de vesículas lipídicas, también podían formarse simplemente exponiendo una muestra seca de lípido al agua. Este fue un avance importante, ya que demostró que las bicapas lipídicas se forman espontáneamente a través de un autoensamblaje y no requieren una estructura de soporte diseñada.
Galería de imágenes
Véase también
 En inglés: Lipid bilayer Facts for Kids
En inglés: Lipid bilayer Facts for Kids
- Proteína de membrana
- Tráfico de vesículas de membrana
- Exocitosis
- Vesículas de membrana externa bacteriana
- Biofísica de membrana
- Polimorfismo de lípidos
- Comportamiento de fase bicapa lipídica
- Liposoma
- Lipidómica
- Modelo de mosaico fluido.
- Modelo de mosaico ligado.
- Coacervado.