Presión osmótica para niños
La presión osmótica es como una fuerza especial que se necesita para detener el movimiento de un líquido, llamado disolvente, a través de una membrana semipermeable. Imagina una pared muy fina que deja pasar algunas cosas pequeñas, como el agua, pero no otras más grandes, como las moléculas de azúcar.
Esta presión es una de las cuatro propiedades coligativas de las soluciones. Esto significa que su valor depende de cuántas partículas hay disueltas en un líquido, no de qué tipo de partículas son. Es muy importante para los seres vivos, porque las membranas de nuestras células controlan lo que entra y sale, actuando como barreras.
Cuando tienes dos líquidos con diferentes cantidades de sustancias disueltas, separados por una membrana semipermeable, el disolvente (por ejemplo, el agua) tiende a moverse desde el lado con menos sustancias disueltas hacia el lado con más. Este movimiento se llama ósmosis. La palabra "ósmosis" viene del griego y significa "impulso". Cuando ocurre la ósmosis, la diferencia de presión osmótica entre los dos lados de la membrana disminuye hasta que se alcanza un equilibrio.
Contenido
¿Qué es la presión osmótica de equilibrio?
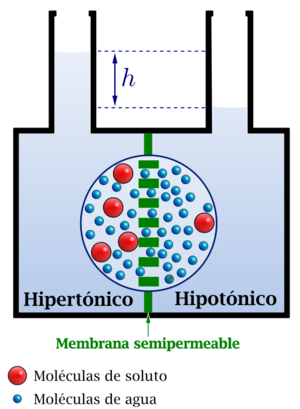
Imagina un recipiente dividido por una membrana semipermeable. En un lado, tienes agua pura (disolvente) y en el otro, agua con azúcar disuelta (solución concentrada). Las moléculas de agua se moverán a través de la membrana hacia el lado del azúcar. A medida que más agua se mueve, el nivel del líquido en el lado del azúcar sube, creando una presión.
Esta presión que se genera por la diferencia de altura del líquido es la presión hidrostática. El movimiento de agua continúa hasta que la presión hidrostática es igual a la presión osmótica. En ese momento, el flujo neto de agua se detiene, aunque todavía haya una diferencia en la concentración de azúcar entre los dos lados.
Breve historia de la presión osmótica
Las primeras ideas sobre la presión osmótica surgieron en 1748 gracias a un abad francés llamado Jean Antoine Nollet. Él descubrió las membranas semipermeables usando una vejiga de cerdo. Puso agua a un lado y una sustancia líquida al otro, y vio que el agua pasaba, pero la sustancia líquida no.
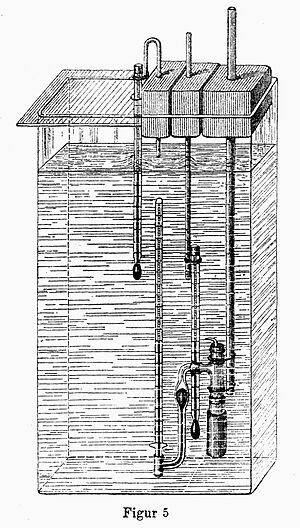
Sin embargo, el descubrimiento de la ósmosis se le atribuye a Henri Dutrochet en 1828. Él notó que el disolvente siempre se movía de la solución menos concentrada a la más concentrada a través de una membrana. También se dio cuenta de que este disolvente en movimiento podía ejercer una presión, que llamó presión osmótica. Dutrochet construyó el primer aparato para medirla, el osmómetro. Él pensó que este fenómeno era muy importante para entender cómo funcionan las células.
Más tarde, en 1877, el científico alemán Wilhelm Pfeffer hizo estudios más precisos. Él creó una membrana semipermeable artificial y midió la presión osmótica en muchas soluciones. Descubrió que:
- La presión osmótica es mayor cuanto más concentrada está la solución.
- La presión osmótica aumenta con la temperatura.
- Dos soluciones con la misma cantidad de partículas disueltas tienen la misma presión osmótica a una temperatura dada.
En 1885, el neerlandés Jacobus Henricus van 't Hoff desarrolló una fórmula para calcular la presión osmótica en soluciones diluidas. Esta fórmula es muy parecida a la que se usa para los gases ideales:
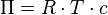
Donde:
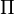 es la presión osmótica.
es la presión osmótica.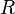 es una constante.
es una constante.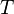 es la temperatura.
es la temperatura. es la concentración de la solución.
es la concentración de la solución.
¿Cómo se explica la presión osmótica?
La teoría de van 't Hoff
Una de las primeras ideas para explicar la ósmosis fue la de van 't Hoff. Él pensó que la presión osmótica se debía a los choques de las moléculas disueltas contra la membrana semipermeable. Imaginó que estas moléculas se comportaban como un gas ideal dentro de la solución.
Otras ideas sobre la ósmosis
Algunos científicos pensaron que las moléculas del disolvente también influían. Propusieron que el disolvente golpea la membrana de forma desigual, causando la ósmosis.
Otra teoría explica la ósmosis basándose en cómo el disolvente se evapora. El disolvente puro se evapora más fácilmente que una solución. Esta diferencia hace que el disolvente se mueva a través de la membrana hasta que las presiones se igualan.
¿Qué tan grande es la presión osmótica?
La presión osmótica se mide en Pascales (Pa) o atmósferas (atm), como otras presiones.
La cantidad de sustancia disuelta en un volumen de solución (llamada molaridad) está directamente relacionada con la presión osmótica. Si una aumenta, la otra también lo hace. Lo mismo ocurre con la temperatura.
Para que te hagas una idea, una solución de azúcar a 20°C con una concentración de 1 mol de azúcar por kilogramo de agua, tiene una presión osmótica de 27.2 atmósferas. ¡Esto es como la presión que sentirías si estuvieras a 281 metros de profundidad bajo el agua! Es una fuerza muy grande.
La presión osmótica en la naturaleza
La presión osmótica en los seres vivos
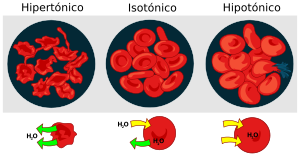
La ósmosis es vital para los seres vivos. Nuestras células están rodeadas de líquidos como la sangre o la linfa, que tienen diferentes concentraciones de sustancias. Las membranas de las células dejan pasar el agua, el oxígeno, el dióxido de carbono y moléculas pequeñas como la glucosa, pero no moléculas grandes como las proteínas.
Las células también pueden mover sustancias en contra de su concentración natural, lo que se llama transporte activo. Por ejemplo, mueven potasio hacia adentro, aunque haya menos potasio fuera.
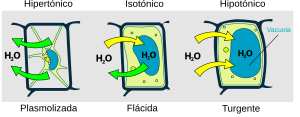
Si la concentración de sustancias que no pueden atravesar la membrana es mayor fuera de la célula, la célula perderá agua por ósmosis. Se dice que el líquido de fuera es hipertónico. Si la concentración es mayor dentro de la célula, esta ganará agua del líquido hipotónico de fuera. Cuando no hay movimiento neto de agua, los líquidos son isotónicos. La sangre y la linfa son isotónicas con nuestras células.
Por eso, las inyecciones que nos ponen en el hospital contienen una solución salina que es isotónica con la sangre. Si inyectaran agua pura, los glóbulos rojos la absorberían por ósmosis hasta que podrían estallar.
Osmorreceptores: los sensores de la ósmosis
Tenemos células especiales llamadas osmorreceptores que detectan cambios en la presión osmótica de nuestros líquidos corporales, como la sangre. Se encuentran en lugares como el hipotálamo. Estas células ayudan a nuestro cuerpo a regular la concentración de sales en nuestros fluidos. Por ejemplo, a través de la hormona antidiurética (ADH), los osmorreceptores controlan la cantidad de agua que eliminamos para mantener la presión osmótica de la sangre en un nivel adecuado.
La absorción de agua en las plantas
Las plantas usan la presión osmótica para que el agua suba desde las raíces hasta las hojas a través de unos tubos llamados xilema. Por ejemplo, en los arces, cuando la nieve se derrite en primavera, el agua entra en las raíces (que tienen muchos azúcares almacenados) y la savia sube por ósmosis.
Sin embargo, en la mayoría de las plantas, la ósmosis no es la única razón por la que la savia sube tan alto. La transpiración de las hojas (cuando el agua se evapora de ellas) crea una especie de "succión" que ayuda a que la savia ascienda. En algunos casos, como los mangles, que viven en agua salada, ocurre un proceso llamado ósmosis inversa para que puedan absorber agua dulce.
Organismos osmófilos
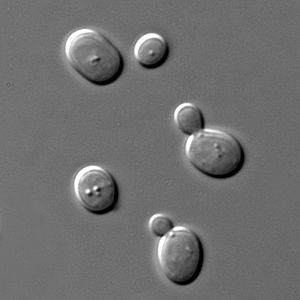
Los organismos osmófilos son seres vivos, casi siempre levaduras, que pueden vivir en ambientes con mucha concentración de azúcares. Son parecidos a los organismos que viven en ambientes muy salados. La alta concentración de azúcar puede ser un problema para muchos microorganismos, pero los osmófilos se protegen produciendo sustancias especiales.
Estos organismos son importantes porque pueden estropear alimentos como los zumos de frutas, los jarabes o la miel. Pero también tienen usos útiles, como en la fermentación de la cerveza. Un ejemplo es la levadura Saccharomyces cerevisiae.
Usos de la presión osmótica
En la ciencia
Una aplicación científica de la presión osmótica es determinar el tamaño de las moléculas grandes. Usando la fórmula de van 't Hoff, los científicos pueden calcular la masa de una sustancia disuelta midiendo la presión osmótica que produce.
En laboratorios
En los laboratorios, se puede medir la concentración total de partículas en una solución (llamada osmolaridad u osmolalidad) midiendo la presión osmótica. Los aparatos que se usan para esto se llaman osmómetros.
En la industria
En la industria se usa la ósmosis inversa. Este proceso es lo contrario de la ósmosis normal. Se aplica una presión muy fuerte a una solución concentrada para forzar al disolvente a pasar a través de la membrana hacia el lado menos concentrado.
La ósmosis inversa se usa en muchas áreas, como en la industria de los alimentos, el papel, la biomedicina y la petroquímica. Una de sus aplicaciones más importantes es la desalinización del agua salada del mar para convertirla en agua potable. Esto ha permitido llevar agua a lugares donde no hay suficientes recursos hídricos.
Véase también
 En inglés: Osmosis Facts for Kids
En inglés: Osmosis Facts for Kids
- Ósmosis
- Propiedad coligativa
- Presión oncótica