Fosforilación oxidativa para niños
La fosforilación oxidativa es un proceso vital en las células que produce la mayor parte de la energía que necesitan para funcionar. Imagina que tus células son como pequeñas fábricas que necesitan energía para hacer todo, desde mover tus músculos hasta pensar. Esa energía se guarda en una molécula especial llamada ATP. La fosforilación oxidativa es la forma más eficiente que tienen las células para fabricar ATP, ¡hasta el 90% de la energía de tu cuerpo se produce así!
Este proceso ocurre en dos etapas principales. Primero, la energía que se libera de reacciones químicas especiales (llamadas reacciones redox) se usa para crear una especie de "pila" de partículas cargadas, llamadas protones, a través de una membrana. Esto se conoce como quimiosmosis. Luego, la energía almacenada en esa "pila" se libera cuando los protones regresan a través de una enzima especial, la ATP sintasa. Esta enzima usa esa energía para añadir un grupo fosfato a una molécula de ADP, transformándola en ATP, que es la moneda de energía de la célula.
En los animales, incluyendo a los humanos, este proceso ocurre principalmente en unas partes de las células llamadas mitocondrias, que son como las "centrales eléctricas" de la célula.
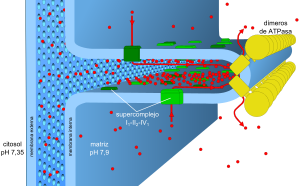
El modelo actual explica que los componentes de la cadena de transporte de electrones están en las crestas mitocondriales y forman grupos llamados supercomplejos. Esto ayuda a que las moléculas que transportan electrones se muevan de forma más eficiente.
Aunque la fosforilación oxidativa es muy importante, también puede producir pequeñas cantidades de sustancias que pueden dañar las células. Sin embargo, las células tienen formas de protegerse y estas sustancias también pueden tener funciones importantes en la comunicación celular.
Contenido
- Descubrimiento de la Fosforilación Oxidativa
- Cómo se Transfiere la Energía: La Quimiosmosis
- Moléculas que Transportan Protones y Electrones
- La Cadena de Transporte de Electrones en Células Eucariotas
- La Cadena de Transporte de Electrones en Células Procariotas
- ATP Sintasa (Complejo V)
- Sustancias que Afectan la Fosforilación Oxidativa
- Galería de imágenes
- Véase también
Descubrimiento de la Fosforilación Oxidativa
El estudio de cómo se produce la energía en las células comenzó hace mucho tiempo.
Primeros Pasos en la Investigación
En 1906, el científico Arthur Harden notó que el fosfato era muy importante para la producción de energía en las células. Al principio, se pensaba que solo ciertos azúcares con fosfato estaban involucrados.
El Papel Central del ATP
A principios de los años 1940, Herman Kalckar y Fritz Albert Lipmann confirmaron que el ATP era la molécula principal para transferir energía en las células. En 1949, otros científicos demostraron que el NADH también estaba relacionado con la producción de ATP.
La Teoría Clave de la Quimiosmosis
Durante muchos años, nadie sabía exactamente cómo se generaba el ATP. El misterio fue resuelto por Peter D. Mitchell en 1961 con su teoría quimiosmótica. Al principio, esta idea fue muy debatida, pero poco a poco fue aceptada y Mitchell recibió el Premio Nobel de Química en 1978 por su descubrimiento.
Avances Recientes
Después de Mitchell, la investigación se centró en estudiar las enzimas involucradas. Científicos como David E. Green y Efraim Racker hicieron contribuciones importantes. Más tarde, Paul D. Boyer propuso en 1973 un mecanismo de "cambio de unión" para la ATP sintasa, y en 1982, la idea de que parte de la enzima rota para producir ATP. Los trabajos más recientes, incluyendo estudios de cristalografía de rayos X por John E. Walker, han ayudado a entender la estructura de estas enzimas. Walker y Boyer también recibieron el Premio Nobel en 1997.
Cómo se Transfiere la Energía: La Quimiosmosis
La fosforilación oxidativa funciona con dos tipos de reacciones que están conectadas. Una libera energía y la otra usa esa energía.
El Flujo de Electrones
El movimiento de electrones a través de la cadena de transporte de electrones (desde moléculas como NADH hasta el oxígeno) libera energía. La fabricación de ATP, en cambio, necesita energía.
La "Pila" de Protones
Tanto la cadena de transporte de electrones como la ATP sintasa están en la membrana de la mitocondria. La energía se transfiere de la cadena de transporte de electrones a la ATP sintasa mediante el movimiento de protones a través de la membrana. Esto se llama quimiosmosis. Es como un circuito eléctrico simple: las enzimas de la cadena de transporte de electrones bombean protones de un lado de la membrana al otro, creando una diferencia de carga y concentración, como una batería. Esta diferencia se llama fuerza protón-motriz.
La ATP Sintasa: Un Motor Molecular
La ATP sintasa libera la energía almacenada permitiendo que los protones fluyan de regreso a través de la membrana. Esta enzima actúa como un motor: usa la fuerza protón-motriz para rotar una parte de su estructura y, con ese movimiento, fabrica ATP.
La cantidad de energía que se produce con la fosforilación oxidativa es muy grande. Por ejemplo, la glucólisis (otro proceso para obtener energía) solo produce dos moléculas de ATP, mientras que la fosforilación oxidativa puede producir entre 30 y 36 moléculas de ATP a partir de una sola molécula de glucosa.
Moléculas que Transportan Protones y Electrones
La cadena de transporte de electrones mueve tanto protones como electrones. Para ello, usa moléculas que pueden estar disueltas o unidas a proteínas.
El Citocromo c
En la mitocondria, los electrones son transportados por una proteína llamada citocromo c. Esta proteína solo transporta electrones, cambiando el estado de un átomo de hierro que tiene en su interior.
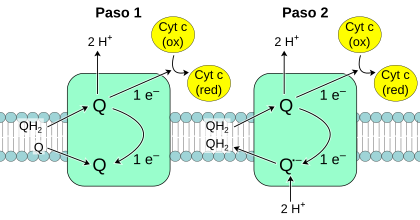
La Coenzima Q
Dentro de la membrana interna de la mitocondria, una molécula llamada coenzima Q10 (Q) transporta tanto electrones como protones. Esta molécula es muy pequeña y se mueve libremente en la membrana. Cuando Q acepta electrones y libera protones, se transforma; y cuando libera electrones y acepta protones, vuelve a su forma original. Así, la coenzima Q ayuda a mover protones a través de la membrana.
Cofactores en las Proteínas
Dentro de las proteínas, los electrones se mueven entre diferentes "cofactores" como las flavinas, los centros hierro-azufre y los citocromos. Estos cofactores metálicos solo transportan electrones, sin unir ni liberar protones. Los electrones pueden moverse rápidamente a través de las proteínas saltando entre estos cofactores.
La Cadena de Transporte de Electrones en Células Eucariotas
Muchos procesos en las células, como la glucólisis o el ciclo de Krebs, producen una molécula llamada NADH. Esta molécula contiene electrones con mucha energía. Las células no liberan toda esta energía de golpe, sino que la liberan poco a poco a través de una serie de enzimas.
Los Complejos de la Cadena
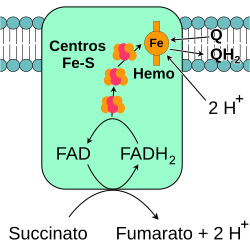
Este conjunto de enzimas, llamado cadena de transporte de electrones, se encuentra en la membrana de la mitocondria. Está formado por cuatro complejos principales (llamados Complejo I, II, III y IV). El succinato también se oxida en esta cadena, pero entra en un punto diferente.
En las células eucariotas (como las nuestras), las enzimas de esta cadena usan la energía de la oxidación del NADH para bombear protones a través de la membrana interna de la mitocondria. Esto hace que se acumulen protones en el espacio entre las membranas, creando un gradiente electroquímico. La energía almacenada en este gradiente es usada por la ATP sintasa para producir ATP.
Se ha descubierto que estas enzimas se encuentran principalmente en las crestas mitocondriales, que son pliegues en la membrana interna de la mitocondria.
| Enzima respiratoria | Par de moléculas | Potencial medio
(Voltios) |
|---|---|---|
| NADH deshidrogenasa | NAD+ / NADH | −0,32 |
| Succinato deshidrogenasa | FMN o FAD / FMNH2 o FADH2 | −0,20 |
| Complejo del citocromo bc1 | Coenzima Q10oxidada / Coenzima Q10reducida | +0,06 |
| Complejo del citocromo bc1 | Citocromo boxidado / Citocromo breducido | +0,12 |
| Complejo IV | Citocromo coxidado / Citocromo creducido | +0,22 |
| Complejo IV | Citocromo aoxidado / Citocromo areducido | +0,29 |
| Complejo IV | O2 / HO- | +0,82 |
| Condiciones: pH = 7 | ||
Complejo I: NADH-ubiquinona oxidorreductasa
El Complejo I es el primer gran grupo de proteínas en la cadena de transporte de electrones. Es una de las enzimas más grandes de la membrana.
Su función principal es tomar electrones del NADH y pasarlos a una quinona (como la ubiquinona). Al mismo tiempo, usa la energía liberada para bombear cuatro protones desde el interior de la mitocondria hacia el espacio entre las membranas.
La reacción general es:

Cómo Funciona el Complejo I
Los electrones se mueven muy rápido a través de este complejo. Primero, dos electrones del NADH pasan a una molécula llamada Flavina mononucleótido. Luego, estos electrones viajan a través de una serie de centros de hierro-azufre dentro de la enzima hasta llegar a la quinona. Este proceso es muy eficiente y ayuda a evitar la formación de sustancias dañinas.
Estructura del Complejo I
El Complejo I es una enzima muy grande y compleja. En los mamíferos, tiene 45 partes (subunidades). En bacterias, es más pequeño, con unas 14 subunidades. Se cree que estas subunidades más pequeñas forman la parte esencial de la enzima.
El complejo tiene forma de "L" y dos partes: una que está en el interior de la mitocondria y otra que está dentro de la membrana. Las siete proteínas esenciales de la parte de la membrana son producidas por el genoma mitocondrial, mientras que el resto son producidas por el genoma principal de la célula.
Complejos Auxiliares
Además de los complejos principales, existen otros grupos de proteínas que también transfieren electrones, pero no bombean protones a través de la membrana.
Complejo II: Succinato-Q oxidorreductasa
El Complejo II es el segundo punto de entrada en la cadena de transporte de electrones. Es especial porque también forma parte del ciclo de Krebs, un proceso importante para la energía celular. Este complejo oxida el succinato y reduce la ubiquinona. Como libera menos energía que el Complejo I, no bombea protones.
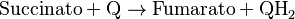
Otras Reductasas y Oxidasas
Muchos organismos tienen cadenas de transporte de electrones diferentes a las de los mamíferos. Por ejemplo, las plantas tienen enzimas que oxidan el NADH en el citosol y transfieren electrones a la ubiquinona sin bombear protones.
También existe la oxidasa alternativa en plantas, hongos y otros organismos. Esta enzima transfiere electrones directamente del ubiquinol al oxígeno. Estas rutas alternativas producen menos ATP, pero pueden ser útiles en situaciones de estrés ambiental, como el frío, o cuando la cadena principal de transporte de electrones está afectada.
Complejo III: Q-citocromo c oxidorreductasa
La Q-citocromo c oxidorreductasa, o Complejo III, es otro complejo importante. En mamíferos, es un grupo de once proteínas que contiene centros de hierro-azufre y citocromos (proteínas con hierro que transportan electrones).
Este complejo oxida una molécula de ubiquinol y reduce dos moléculas de citocromo c. A diferencia de la coenzima Q, que transporta dos electrones, el citocromo c solo transporta uno.

La reacción del Complejo III es un poco más complicada y ocurre en dos pasos, lo que se llama ciclo Q. Este ciclo es importante porque aumenta la eficiencia con la que se bombean los protones.
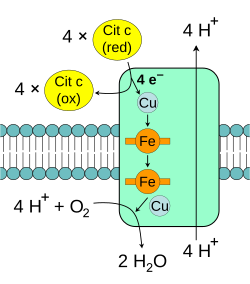
Complejo IV: Citocromo c oxidasa
La citocromo c oxidasa, o Complejo IV, es el último grupo de proteínas en la cadena de transporte de electrones. Es muy complejo y tiene trece partes, dos grupos hemo y varios iones metálicos como cobre y zinc.
Esta enzima realiza la reacción final de la cadena: transfiere los electrones al oxígeno, que es el aceptor final, y lo convierte en agua. Al mismo tiempo, bombea protones a través de la membrana. Tanto el bombeo directo de protones como el uso de protones para formar agua contribuyen al gradiente de protones.
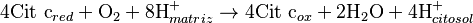
Cómo se Organizan los Complejos
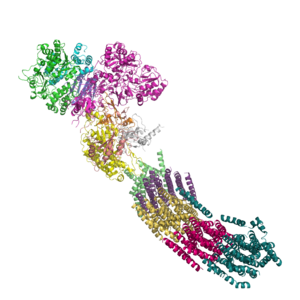
Al principio, se pensaba que los complejos de la cadena respiratoria se movían libremente en la membrana de la mitocondria. Sin embargo, estudios recientes sugieren que podrían formar estructuras más grandes llamadas supercomplejos o "respirasomas". En este modelo, varios complejos se agrupan, lo que podría hacer que la transferencia de electrones sea más rápida y eficiente.
La Cadena de Transporte de Electrones en Células Procariotas
A diferencia de las células eucariotas, las bacterias y arqueas (que son procariotas) tienen una gran variedad de enzimas para transferir electrones. Esto les permite vivir en muchos tipos diferentes de ambientes.
Diversidad en Procariotas
Al igual que en las eucariotas, la cadena de transporte de electrones en procariotas usa la energía liberada de una reacción para bombear iones a través de la membrana y crear un gradiente electroquímico. La principal diferencia es que las bacterias y arqueas pueden usar muchos tipos diferentes de moléculas para donar y aceptar electrones.
Por ejemplo, la bacteria Escherichia coli puede usar diferentes sustancias como donantes de electrones (como formiato, hidrógeno o lactato) y diferentes sustancias como aceptores (como nitrato, DMSO u oxígeno). Esta flexibilidad les permite adaptarse a diversas condiciones ambientales.
| Enzima respiratoria | Par de moléculas | Potencial medio
(Voltios) |
|---|---|---|
| Formiato deshidrogenasa | Bicarbonato / Formiato | −0,43 |
| Hidrogenasa | Protón / Hidrógeno | −0,42 |
| NADH deshidrogenasa | NAD+ / NADH | −0,32 |
| Glicerol-3-fosfato deshidrogenasa | DHAP / Gli-3-P | −0,19 |
| Piruvato oxidasa | Acetato + Dióxido de carbono / Piruvato | ? |
| Lactato deshidrogenasa | Piruvato / Lactato | −0,19 |
| D-aminoácido deshidrogenasa | 2-oxoácido + Amoníaco / D-aminoácido | ? |
| Glucosa deshidrogenasa | Gluconato / Glucosa | −0,14 |
| Succinato deshidrogenasa | Fumarato / Succinato | +0,03 |
| Ubiquinol oxidasa | Oxígeno / Agua | +0,82 |
| Nitrato reductasa | Nitrato / Nitrito | +0,42 |
| Nitrito reductasa | Nitrito / Amoníaco | +0,36 |
| Dimetil sulfóxido reductasa | DMSO / DMS | +0,16 |
| Trimetilamina N-óxido reductasa | TMAO / TMA | +0,13 |
| Fumarato reductasa | Fumarato / Succinato | +0,03 |
Los procariotas pueden cambiar las enzimas que producen según las condiciones del ambiente. Esta flexibilidad es posible porque diferentes enzimas usan las mismas reservas de ubiquinona, lo que permite muchas combinaciones de enzimas que trabajan juntas.
ATP Sintasa (Complejo V)
La ATP sintasa, también llamada Complejo V, es la enzima final de la fosforilación oxidativa. Se encuentra en todas las formas de vida y funciona de manera similar en procariotas y eucariotas.
Función de la ATP Sintasa
Esta enzima usa la energía almacenada en el gradiente de protones a través de la membrana para fabricar ATP a partir de ADP y fosfato. Se estima que se necesitan entre tres y cuatro protones para producir una molécula de ATP.
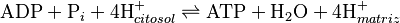
Si no hay un gradiente de protones, la ATP sintasa puede funcionar al revés, usando ATP para bombear protones. Pero cuando el gradiente de protones es alto, la enzima es forzada a producir ATP.
Estructura de la ATP Sintasa
La ATP sintasa es un complejo de proteínas muy grande con forma de hongo. En mamíferos, tiene 16 partes y es muy grande. La parte que está dentro de la membrana se llama FO y tiene un canal por donde pasan los protones. La parte superior, que parece una esfera, se llama F1 y es donde se fabrica el ATP.
Cuando los protones pasan a través del canal en la base de la ATP sintasa, la parte FO empieza a girar. Esta rotación hace que un eje central (la subunidad γ) también gire dentro de la parte F1. Este movimiento del eje central proporciona la energía para que los sitios activos de la enzima fabriquen y luego liberen el ATP.
La forma en que se fabrica el ATP se llama "mecanismo de cambio de unión". En este proceso, el ADP y el fosfato entran en un sitio activo de la enzima. La enzima los une ligeramente, luego cambia de forma para unirlos más fuerte y formar ATP. Finalmente, el sitio activo vuelve a su forma original, liberando el ATP y preparándose para el siguiente ciclo.
Sustancias que Afectan la Fosforilación Oxidativa
Existen varias sustancias que pueden detener o modificar la fosforilación oxidativa. Aunque estas sustancias pueden afectar solo una parte de la cadena de transporte de electrones, la interrupción de cualquier paso detiene todo el proceso.
- Cianuro: Esta sustancia detiene la cadena de transporte de electrones al bloquear el paso de electrones en el Complejo IV. Esto impide que se genere el gradiente de protones y, por lo tanto, que se produzca ATP.
- Oligomicina: Este antibiótico detiene la ATP sintasa al interferir con el transporte de protones. Esto impide la síntesis de ATP y, como consecuencia, también detiene la cadena de transporte de electrones.
- 2,4-Dinitrofenol: Esta sustancia "desacopla" la cadena de transporte de electrones de la fosforilación oxidativa. Permite que los protones atraviesen la membrana interna de la mitocondria sin pasar por la ATP sintasa. Así, la cadena de transporte de electrones sigue funcionando, pero no se produce ATP.
| Compuesto | Uso | Efecto en la fosforilación oxidativa |
|---|---|---|
| Cianuro y monóxido de carbono |
Sustancia que detiene procesos biológicos | Detienen la cadena de transporte de electrones al unirse a los centros de hierro-cobre en la citocromo c oxidasa, impidiendo que el oxígeno se reduzca. |
| Oligomicina | Antibiótico | Detiene la ATP sintasa al bloquear el flujo de protones a través de la subunidad Fo. |
| CCCP 2,4-Dinitrofenol |
Sustancia que detiene procesos biológicos | Interrumpen el gradiente de protones transportándolos a través de la membrana. Esto separa el bombeo de electrones de la ATP sintasa. |
| Rotenona | Sustancia para controlar plagas | Impide la transferencia de electrones del Complejo I a la ubiquinona al bloquear los sitios de unión. |
| Malonato y oxaloacetato | Sustancias que compiten con la succinato deshidrogenasa (Complejo II). |
No todas las sustancias que afectan la fosforilación oxidativa son perjudiciales. En el tejido adiposo marrón, unas proteínas especiales llamadas proteínas desacopladoras pueden separar la respiración de la producción de ATP. Esta respiración rápida produce calor, lo cual es muy importante para mantener la temperatura corporal en animales que hibernan.
Galería de imágenes
-
El bioquímico Arthur Harden
Véase también
 En inglés: Electron transport chain Facts for Kids
En inglés: Electron transport chain Facts for Kids