Bromuro de litio para niños
Datos para niños
Bromuro de litio |
||
|---|---|---|
 |
||
| General | ||
| Fórmula molecular | LiBr | |
| Identificadores | ||
| Número CAS | 231-439-8 | |
|
InChI
InChI=InChI=1S/BrH.Li/h1H;/q;+1/p-1
Key: AMXOYNBUYSYVKV-UHFFFAOYSA-M |
||
| Propiedades físicas | ||
| Apariencia | cristales | |
| Densidad | 3464 kg/m³; 3,464 g/cm³ | |
| Masa molar | 86,845 g/mol | |
| Punto de fusión | 552 °C (825 K) | |
| Punto de ebullición | 1265 °C (1538 K) | |
| Índice de refracción (nD) | 1,784 | |
| Propiedades químicas | ||
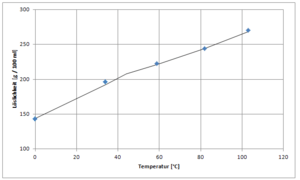
| Solubilidad en agua | 145 g/100 mL (4 °C) 166,7 g/100 mL (20 °C) 254 g/100 mL (90 °C) |
|
| Peligrosidad | ||
| NFPA 704 |
0
2
0
|
|
| Compuestos relacionados | ||
| Sales alcalinas de Bromo | Bromuro potásico (KBr), Bromuro sódico (NaBr), Bromuro de rubidio (RbBr), Bromuro de cesio (CsBr) | |
| Halogenuros | Fluoruro de litio (LiF), Cloruro de litio (LiCl), Yoduro de litio (LiI) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El bromuro de litio (LiBr) es un compuesto químico formado por los elementos litio y bromo. Es conocido por su gran capacidad para absorber agua. Por esta razón, se usa mucho como un agente para secar el aire en sistemas de aire acondicionado.
Además del bromuro de litio en su forma pura (sin agua), existen varias formas que contienen moléculas de agua, llamadas hidratos. Se conocen hidratos con 1, 2, 3 y 5 moléculas de agua. El monohidrato (LiBr•H2O) tiene una densidad de 2,51 gramos por centímetro cúbico. A diferencia de otros bromuros de metales alcalinos, el bromuro de litio puede presentarse en varias formas cristalinas. La sal pura forma cristales con forma de cubo, parecidos a la sal de mesa. Para quitarle toda el agua, se debe calentar al vacío a 90 °C.
Contenido
¿Cómo se obtiene el bromuro de litio?
El bromuro de litio se puede fabricar de varias maneras. Una forma común es mezclando una solución de hidróxido de litio o carbonato de litio con bromuro de hidrógeno en agua.
Aquí te mostramos las reacciones químicas:
- Cuando el hidróxido de litio reacciona con el bromuro de hidrógeno:

- Cuando el carbonato de litio reacciona con el bromuro de hidrógeno:
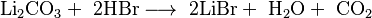
También se puede obtener bromuro de litio puro (sin agua) haciendo reaccionar hidruro de litio con bromo.
- Reacción de hidruro de litio con bromo:

Propiedades importantes del bromuro de litio
El bromuro de litio es un material higroscópico. Esto significa que absorbe la humedad del aire con mucha facilidad. Las soluciones concentradas de bromuro de litio (con un 50% de LiBr) pueden reducir la presión del vapor de agua en el aire hasta en un 80%.
Es muy soluble en agua a 20 °C. También se disuelve en alcohol y en glicol de etileno. La cantidad de bromuro de litio que se puede disolver en agua cambia mucho con la temperatura. Dependiendo de la temperatura, se forman diferentes hidratos:
- Por debajo de 4 °C, se forma el trihidrato (LiBr•3H2O).
- Entre 4 °C y 44 °C, se forma el dihidrato (LiBr•2H2O).
- Entre 44 °C y 159 °C, se forma el monohidrato (LiBr•H2O).
A temperaturas más altas, la forma pura (sin agua) es estable.
La energía que se libera o absorbe cuando se forma el bromuro de litio (conocida como entalpía estándar de formación) es de -351 kJ/mol.
¿Para qué se usa el bromuro de litio?
El bromuro de litio tiene varios usos importantes:
- Sistemas de refrigeración: Se usa en soluciones acuosas para máquinas de absorción, que son un tipo de sistema de enfriamiento. Más de la mitad del bromuro de litio que se produce se utiliza para esto.
- Agente secante: Gracias a su gran capacidad para absorber humedad, se emplea en sistemas de refrigeración, aire acondicionado y secado industrial. Una solución concentrada de este compuesto es muy efectiva para eliminar el vapor de agua del ambiente.
- En la industria textil: Se utiliza para ayudar a disolver ciertas proteínas y para aumentar el volumen de materiales como la lana y el pelo.
- Fabricación de productos químicos: Se usa como un catalizador (una sustancia que acelera una reacción química) y como un reactivo en la química orgánica.
- Soldadura: Sirve como un fundente, que es una sustancia que ayuda a limpiar las superficies metálicas para que se puedan unir mejor al soldar.
- Baterías: Se emplea como un electrolito en algunos tipos de pilas de litio.
Uso en la salud
A principios del siglo XX, el bromuro de litio se usaba para calmar a las personas. Sin embargo, en la década de 1940, se dejó de usar porque causó problemas de salud graves en algunas personas, especialmente en aquellas con problemas de corazón. Hoy en día, las sales de litio, como el bromuro de litio, se usan bajo supervisión médica para ayudar a personas con ciertas condiciones de salud mental.
Posibles riesgos
Las sales de litio pueden afectar el cuerpo y, si no se manejan correctamente, pueden ser corrosivas (pueden dañar los tejidos). Por eso, es importante que solo sean usadas por profesionales y bajo estrictas medidas de seguridad.
Ver también
- Bromuro
- Frío solar
Véase también
 En inglés: Lithium bromide Facts for Kids
En inglés: Lithium bromide Facts for Kids