Trifluoruro de cloro para niños
Datos para niños
trifluoruro de cloro |
||
|---|---|---|
 |
||
 |
||
| General | ||
| Fórmula molecular | ClF3 | |
| Identificadores | ||
| Número CAS | 7790-91-2 | |
|
InChI
InChI=InChI=1S/ClF3/c2-1(3)4
Key: JOHWNGGYGAVMGU-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Densidad | 4000 kg/m³; 4 g/cm³ | |
| Masa molar | 92,45 g/mol | |
| Punto de fusión | −76,34 °C (197 K) | |
| Punto de ebullición | 11,75 °C (285 K) | |
| Presión de vapor | 175 kPa | |
| Viscosidad | 91,82 μPa s | |
| Termoquímica | ||
| ΔfH0gas | −158,87 kJ/mol | |
| S0gas, 1 bar | 281,59 J K−1mol−1[3] J·mol–1·K | |
| Peligrosidad | ||
| NFPA 704 |
0
4
3
W+OX
|
|
| Frases R | R8, R14, R39/26/27/28, R35, R45, R46, R60, R61 | |
| Frases S | S1/2, S17, S30, S38, S45, S53, S60, S61 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El trifluoruro de cloro es un compuesto químico con la fórmula ClF3. Es un gas sin color y muy reactivo. Cuando se enfría, se convierte en un líquido de color amarillo verdoso. Este líquido es la forma en que se suele vender y usar. Se utiliza en la industria para limpiar materiales y en el procesamiento de ciertos combustibles.
Contenido
¿Qué es el Trifluoruro de Cloro?
El trifluoruro de cloro es un tipo de compuesto llamado "interhalógeno". Esto significa que está formado por dos elementos del grupo de los halógenos: el cloro y el flúor.
¿Cómo se obtiene?
Este compuesto fue mencionado por primera vez en 1930 por los científicos Ruff y Krug. Ellos lo crearon al combinar flúor con cloro. Después, separaron el trifluoruro de cloro de otras sustancias mediante un proceso llamado destilación.
La reacción química para obtenerlo es:
- 3 F2 + Cl2 → 2 ClF3
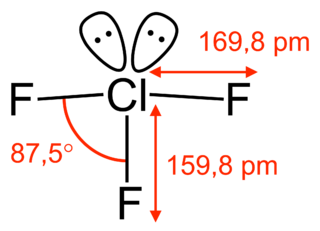
¿Cómo es su estructura?
El trifluoruro de cloro tiene una forma especial que se parece a la letra "T". Sus enlaces químicos no son todos iguales; algunos son más cortos y otros más largos. Esta forma se explica por una teoría llamada VSEPR, que ayuda a predecir cómo se organizan los átomos en una molécula.
Este compuesto es estable a temperaturas de hasta 180 °C si se guarda en recipientes especiales. Si la temperatura sube más, puede descomponerse en sus elementos originales.
¿Cómo reacciona?
El trifluoruro de cloro es muy reactivo y puede combinarse con muchos materiales. Por ejemplo, al reaccionar con metales, forma cloruros y fluoruros. Con el fósforo, produce tricloruro de fósforo y pentafluoruro de fósforo. Si reacciona con azufre, forma dicloruro de azufre y tetrafluoruro de azufre.
También reacciona de forma muy fuerte con el agua. Cuando esto sucede, puede producir oxígeno o difluoruro de oxígeno, además de fluoruro de hidrógeno y cloruro de hidrógeno.
Aquí tienes un ejemplo de cómo reacciona con el agua:
- ClF3 + 2H2O → 3HF + HCl + O2
¿Por qué es peligroso?
El trifluoruro de cloro es un químico muy potente. Es extremadamente reactivo con casi todo, incluyendo materiales que normalmente no se queman, como el vidrio o el teflón. Puede hacer que muchos materiales se enciendan sin necesidad de una chispa o fuego. Estas reacciones suelen ser muy fuertes y a veces pueden causar explosiones.
Es tan potente que puede corroer materiales que se consideran muy resistentes. Por eso, cualquier equipo que entre en contacto con él debe ser limpiado con mucho cuidado. Si hay alguna impureza, podría reaccionar de forma explosiva.
Además, es muy difícil apagar un fuego causado por trifluoruro de cloro. Los métodos comunes para apagar incendios, como el anhídrido carbónico o el agua, no funcionan y pueden incluso empeorar la situación. El contacto con este compuesto, ya sea líquido o gas, puede causar quemaduras graves en la piel. Cuando reacciona con agua, produce vapores de ácido fluorhídrico y ácido clorhídrico, que son muy corrosivos.
¿Para qué se usa?
El trifluoruro de cloro tiene varias aplicaciones importantes en la industria.
Limpieza en la Industria de Semiconductores
En la fabricación de semiconductores, el trifluoruro de cloro se usa para limpiar las cámaras donde se depositan materiales. La ventaja es que puede limpiar las paredes de la cámara sin necesidad de desarmarla. El calor de la cámara es suficiente para que el trifluoruro de cloro reaccione y limpie los residuos.
Combustible para Cohetes (y sus desafíos)
Se ha estudiado el trifluoruro de cloro como un posible combustible para cohetes debido a su alta energía. Sin embargo, su uso es muy complicado y peligroso. Un experto en cohetes, John D. Clark, describió los desafíos de usarlo:
"Es extremadamente peligroso. Reacciona muy rápido con cualquier combustible conocido. También reacciona con cosas como tela, madera y hasta con el asbesto, la arena y el agua, con los que reacciona de forma explosiva. Se puede guardar en algunos metales comunes, como el acero o el aluminio, porque forma una capa protectora. Pero si esa capa se daña, el operador se enfrenta a un incendio de metal y flúor. Para eso, lo mejor es salir corriendo."
Este compuesto también se usa para producir hexafluoruro de uranio, que es parte del procesamiento de combustible nuclear.
Véase también
 En inglés: Chlorine trifluoride Facts for Kids
En inglés: Chlorine trifluoride Facts for Kids


