Tetrafluoruro de azufre para niños
Datos para niños
tetrafluoruro de azufre |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Fluoruro de azufre(IV) | ||
| General | ||
| Otros nombres | Tetrafluoruro de azufre | |
| Fórmula molecular | SF4 | |
| Identificadores | ||
| Número CAS | 7783-60-0 | |
|
InChI
InChI=InChI=1S/F4S/c1-5(2,3)4
Key: QHMQWEPBXSHHLH-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | transparente | |
| Masa molar | 108,07 g/mol | |
| Punto de fusión | −121.0 | |
| Punto de ebullición | −38 | |
| Propiedades químicas | ||
| Momento dipolar | 0.632 D D | |
| Peligrosidad | ||
| NFPA 704 |
0
3
2
W
|
|
| Frases R | R26 R35 | |
| Frases S | S(1) S9 S26 S36/37/39 S45 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El tetrafluoruro de azufre es un compuesto químico con la fórmula SF4. A temperatura ambiente, es un gas transparente. Este gas es muy reactivo y puede ser peligroso si entra en contacto con agua o humedad, ya que libera una sustancia que puede causar quemaduras.
A pesar de sus características, el tetrafluoruro de azufre es muy útil en la química. Se usa para crear otros compuestos que contienen flúor, llamados organofluorados. Algunos de estos compuestos son importantes en la fabricación de medicinas y productos químicos especiales.
Contenido
¿Cómo es la estructura del tetrafluoruro de azufre?
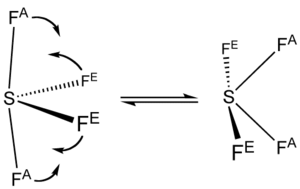
En el SF4, el azufre tiene un "estado de oxidación" de +4. Esto significa que comparte sus electrones de valencia de una manera particular. De los seis electrones de valencia del azufre, dos forman un "par solitario" que no se une a otros átomos.
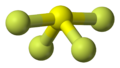
La forma de la molécula de SF4 se puede entender usando una teoría llamada VSEPR. Esta teoría ayuda a predecir cómo se organizan los átomos en una molécula. La molécula de SF4 tiene una forma que se parece a un "balancín", con el átomo de azufre en el centro.
Uno de los lugares en el "balancín" está ocupado por el par de electrones solitario. Por eso, la molécula tiene dos tipos de enlaces con el flúor: dos enlaces "axiales" y dos "ecuatoriales". Los enlaces axiales son un poco más largos y, por lo tanto, más débiles que los ecuatoriales.
En contraste, el hexafluoruro de azufre (SF6) es diferente. En el SF6, el azufre usa todos sus electrones para unirse al flúor, así que no le quedan pares solitarios. Esto hace que el SF6 tenga una forma muy simétrica, llamada octaédrica, y sea mucho menos reactivo que el SF4.
Aunque el SF4 tiene dos tipos de enlaces con el flúor, los átomos de flúor cambian de posición muy rápido. Esto se llama "pseudorrotación". Es tan rápido que, si lo observaras con una técnica especial llamada espectrometría de RMN, verías que todos los átomos de flúor parecen iguales.
¿Cómo se fabrica el tetrafluoruro de azufre?
El tetrafluoruro de azufre se puede producir de varias maneras en un laboratorio. Una forma es haciendo reaccionar directamente el flúor con el azufre.
También se puede obtener a partir de la reacción de dicloruro de azufre (SCl2) con fluoruro de sodio (NaF) y cloro (Cl2). Otra forma es usando solo dicloruro de azufre y fluoruro de sodio.
Existen otros métodos que involucran la reacción de azufre con trifluoruro de cobalto a altas temperaturas.
¿Qué propiedades tiene el tetrafluoruro de azufre?
Propiedades físicas del SF4
El tetrafluoruro de azufre es un gas que no tiene color y huele fuerte. No se quema fácilmente. Se descompone si se mezcla con agua, y si se calienta mucho, puede formar fluoruro de hidrógeno.
Tiene un "punto de fusión" muy bajo, de -121 °C, lo que significa que se convierte en líquido a temperaturas extremadamente frías. Su "punto de ebullición" es de -38 °C, por lo que se convierte en gas a temperaturas también muy bajas.
Propiedades químicas del SF4
Este compuesto es muy reactivo. Si se calienta a temperaturas muy altas (entre 600 y 700 °C), se descompone para formar hexafluoruro de azufre (SF6) y azufre.
Cuando el tetrafluoruro de azufre entra en contacto con la humedad del aire, reacciona para formar fluoruro de tionilo (SOF2) y fluoruro de hidrógeno (HF). Si reacciona con agua directamente, produce dióxido de azufre (SO2) y fluoruro de hidrógeno.
También reacciona con sustancias alcalinas, como el hidróxido de sodio (NaOH), formando otros compuestos.
¿Para qué se usa el tetrafluoruro de azufre?
El SF4 es muy importante en la síntesis orgánica. Se utiliza para cambiar ciertos grupos de átomos en moléculas. Por ejemplo, puede transformar grupos que contienen oxígeno (como COH o C=O) en grupos que contienen flúor (como CF o CF2).
Esto es útil para crear fluorocarbonos, que son compuestos con muchos usos. Por ejemplo, si se trata un ácido carboxílico con SF4, se pueden obtener derivados que contienen tres átomos de flúor.
Los productos que quedan después de estas reacciones, como el SF4 que no reaccionó, el fluoruro de tionilo y el dióxido de azufre, pueden ser peligrosos. Por eso, se deben tratar con hidróxido de potasio para neutralizarlos y hacerlos seguros.
En los últimos años, se ha empezado a usar otro compuesto, el trifluoruro dietilaminoazufre (DAST), en lugar del SF4. El DAST es más fácil de manejar y se prepara a partir del SF4.
Otras aplicaciones del SF4
El tetrafluoruro de azufre también se usa para producir el cloruro de pentafluoruro de azufre (SF5Cl). Este último es una fuente útil de grupos SF5, que son importantes en la química.
Galería de imágenes
ja:フッ化硫黄#四フッ化硫黄
Véase también
 En inglés: Sulfur tetrafluoride Facts for Kids
En inglés: Sulfur tetrafluoride Facts for Kids