Difluoruro de oxígeno para niños
Datos para niños
|
||
|---|---|---|
  |
||
| Nombre IUPAC | ||
| Difluoruro de oxígeno | ||
| General | ||
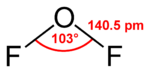
| Fórmula semidesarrollada | FOF | |
| Fórmula molecular | OF2 | |
| Identificadores | ||
| Número CAS | 7783-41-7 | |
| ChEBI | 30494 | |
| ChemSpider | 22953 | |
| PubChem | 24547 | |
| UNII | 7BCS2CW398 | |
|
InChI
InChI=InChI=1S/F2O/c1-3-2
Key: UJMWVICAENGCRF-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Gas incoloro, condensado es un líquido de color pálido amarillo. | |
| Densidad | 1900 kg/m³; 1,9 g/cm³ | |
| Masa molar | 53,9962 g/mol | |
| Punto de fusión | 49,35 K (−224 °C) | |
| Punto de ebullición | 128,35 K (−145 °C) | |
| Índice de refracción (nD) |
+ KPS = |
|
| Termoquímica | ||
| ΔfH0gas | 24.5 kJ mol−1 kJ/mol | |
| Peligrosidad | ||
| SGA |     |
|
| NFPA 704 |
0
4
3
OX
|
|
| Riesgos | ||
| Inhalación | Tóxico (vapores de flúor), puede causar dolores de cabeza | |
| Piel | Congelamiento (en caso de estar líquido) | |
| Ojos | Quemaduras graves | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El difluoruro de oxígeno es un compuesto químico con la fórmula OF2. Aunque su estructura es parecida a la del agua, sus propiedades son muy diferentes. Este compuesto es un oxidante fuerte, lo que significa que puede quitar electrones a otras sustancias. Esto se debe a que contiene flúor y oxígeno, que son dos de los elementos más "electronegativos" (que atraen electrones con mucha fuerza).
Contenido
¿Qué es el Difluoruro de Oxígeno?
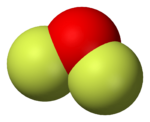
El difluoruro de oxígeno (OF2) es un compuesto químico interesante. A temperatura ambiente, es un gas que no tiene color. Si se enfría mucho, se convierte en un líquido de un color amarillo muy pálido.
Su fórmula química, OF2, nos dice que está formado por un átomo de oxígeno y dos átomos de flúor. La forma en que estos átomos se unen es similar a cómo se unen en una molécula de agua (H2O). Sin embargo, el OF2 se comporta de manera muy distinta al agua.
Propiedades Físicas del OF2
- Apariencia: Es un gas sin color. Si se enfría mucho, se vuelve un líquido amarillo claro.
- Densidad: Es bastante denso, con 1.9 gramos por centímetro cúbico.
- Punto de Fusión: Se congela a temperaturas extremadamente bajas, alrededor de -224 °C.
- Punto de Ebullición: Hierve y se convierte en gas a -145 °C.
¿Cómo se obtiene el Difluoruro de Oxígeno?
El difluoruro de oxígeno fue descubierto por primera vez en el año 1929. En aquel entonces, se obtenía usando un proceso llamado electrólisis. Este proceso usaba fluoruro de potasio y ácido fluorhídrico mezclados con un poco de agua.
Hoy en día, la forma más común de prepararlo es haciendo reaccionar diflúor (F2) con una solución diluida de hidróxido de sodio (NaOH). Esta reacción también produce fluoruro de sodio (NaF) y agua (H2O) como productos secundarios.
La reacción se ve así:
- 2 F2 + 2 NaOH → OF2 + 2 NaF + H2O
¿Cómo reacciona el Difluoruro de Oxígeno?
El difluoruro de oxígeno es un oxidante muy potente. Esto significa que es muy bueno quitando electrones a otras sustancias en reacciones químicas. Normalmente, el oxígeno en los compuestos tiende a "ganar" electrones, pero en el OF2, el flúor es tan fuerte que el oxígeno termina "perdiendo" electrones, lo cual es muy inusual.
Cuando se calienta por encima de los 200 °C, el OF2 se descompone. Se separa en dioxígeno (O2) y diflúor (F2).
Reacciones con otros elementos
El OF2 puede reaccionar con muchos metales, formando óxidos y fluoruros. También reacciona con algunos no-metales. Por ejemplo:
- Con el fósforo, forma PF5 y POF3.
- Con el azufre, forma SO2 y SF4.
- Incluso puede reaccionar con el xenón, que es un gas noble (un tipo de gas que casi nunca reacciona con nada), para producir XeF4 y otros compuestos de xenón con oxígeno y flúor.
Reacciones con agua y dióxido de azufre
El OF2 reacciona muy lentamente con el agua para formar ácido fluorhídrico y oxígeno:
- OF2 (aq) + H2O (aq) → 2 HF (aq) + O2 (g)
También puede oxidar el dióxido de azufre (SO2) para convertirlo en trióxido de azufre (SO3):
- OF2 + SO2 → SO3 + F2
Sin embargo, si esta reacción ocurre bajo la luz ultravioleta, se forman otros compuestos como el fluoruro de sulfurilo (SO2F2) y S2O5F2:
- OF2 + 2 SO2 → S2O5F2
Precaución al manejar Difluoruro de Oxígeno
Es muy importante saber que el difluoruro de oxígeno es un compuesto peligroso. Al igual que otros oxidantes fuertes, debe ser manejado con mucho cuidado por expertos en laboratorios.
- Inhalación: Sus vapores pueden ser perjudiciales y causar dolores de cabeza.
- Piel: Si el líquido toca la piel, puede causar congelación.
- Ojos: El contacto con los ojos puede provocar quemaduras graves.
Véase también
 En inglés: Oxygen difluoride Facts for Kids
En inglés: Oxygen difluoride Facts for Kids


