Dimetilsulfuro para niños
Datos para niños
Dimetilsulfuro |
||
|---|---|---|
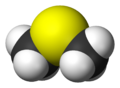
 Modelo de espacio lleno
|
||
| Nombre IUPAC | ||
| (Metilsulfanil)metano | ||
| General | ||
| Otros nombres | (Metiltio)metano, Sulfuro de dimetilo. | |
| Fórmula estructural | ||
| Fórmula molecular | C2H6S | |
| Identificadores | ||
| Número CAS | 75-18-3 | |
| Número RTECS | PV5075000 | |
| ChEBI | 17437 | |
| ChEMBL | CHEMBL15580 | |
| ChemSpider | 1039 | |
| PubChem | 1068 | |
| UNII | QS3J7O7L3U | |
| KEGG | C00580 | |
|
InChI
InChI=InChI=1S/C2H6S/c1-3-2/h1-2H3
Key: QMMFVYPAHWMCMS-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Líquido incoloro. | |
| Olor | Col, sulfuroso. | |
| Densidad | 846 kg/m³; 0,846 g/cm³ | |
| Masa molar | 62,019 g/mol | |
| Punto de fusión | − 98 °C (371 K) | |
| Punto de ebullición | 35 °C (308 K) a 41 °C (314 K) | |
| Presión de vapor | 53,7 kPa (a 20 °C). | |
| Índice de refracción (nD) | 1,435 | |
| Propiedades químicas | ||
| log P | 0,977 | |
| Termoquímica | ||
| ΔfH0gas | − 66,9 a − 63,9 kJ/mol | |
| Peligrosidad | ||
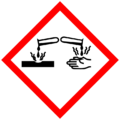
| SGA |    |
|
| Punto de inflamabilidad | 237 K (−36 °C) | |
| Temperatura de autoignición | 479 K (206 °C) | |
| Frases H | H225, H315, H318, H335. | |
| Frases P | P210, P261, P280, P305+351+338. | |
| Límites de explosividad | 19,7% | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El dimetilsulfuro (DMS) es un compuesto químico que contiene azufre. Su fórmula es (CH3)2S. Es el tioéter más sencillo. Se presenta como un líquido que se enciende fácilmente y hierve a los 37 °C. Tiene un olor muy particular y fuerte.
Este compuesto forma parte del olor que se produce al cocinar algunos alimentos. Por ejemplo, lo encontramos en el maíz, la col, la remolacha y los mariscos. También puede indicar si hay bacterias en la producción de malta y cerveza. El DMS se forma cuando se descompone otra sustancia llamada dimetilsulfoniopropionato (DMSP). También se produce por la acción de bacterias sobre el metanotiol.
Contenido
¿Dónde se encuentra y cómo se produce el dimetilsulfuro?
El DMS se obtiene principalmente del DMSP. El DMSP es una sustancia importante que producen algunas algas marinas. El dimetilsulfuro es el compuesto de azufre biológico más común que se libera al aire. Esto ocurre en los océanos gracias al fitoplancton.
El DMS también se forma de manera natural. Esto sucede cuando las bacterias transforman los restos de dimetilsulfóxido (DMSO). Estos restos pueden llegar a las alcantarillas y causar olores molestos.
El dimetilsulfuro y el clima
En la atmósfera marina, el DMS se transforma en otros compuestos con azufre. Algunos de ellos son el dióxido de azufre y el ácido sulfúrico. El ácido sulfúrico puede crear nuevas partículas muy pequeñas llamadas aerosoles. Estas partículas actúan como núcleos para que se formen las nubes.
Por esta razón, la gran cantidad de DMS que se produce en la atmósfera sobre los océanos puede influir en el clima de la Tierra. La hipótesis CLAW sugiere que el DMS podría tener un papel clave en el equilibrio del planeta.
El olor del mar y las plantas
El fitoplancton marino también produce dimetilsulfuro. Además, el DMS se genera por la acción de bacterias sobre el DMSP que está fuera de las células. A menudo se le llama el «olor del mar». Sin embargo, es más preciso decir que el DMS es una parte de ese olor. Otros componentes son derivados químicos del DMS y feromonas de algas.
Se ha descubierto que el dimetilsulfuro, el disulfuro de dimetilo y el trisulfuro de dimetilo son sustancias que desprenden algunas plantas. Por ejemplo, la planta conocida como «yaro tragamoscas» (Helicodiceros muscivorus) los libera. Estos compuestos crean un olor parecido al de la carne en descomposición. Este olor atrae a polinizadores que se alimentan de carroña, como muchas especies de moscas.
¿Cómo se fabrica el dimetilsulfuro en la industria?
En la industria, el dimetilsulfuro se fabrica de una forma especial. Se usa sulfuro de hidrógeno con mucho metanol. Esta mezcla se calienta con un catalizador de óxido de aluminio.
La reacción es la siguiente: 2 CH3OH + H2S → (CH3)2S + 2 H2O
El dimetilsulfuro también se libera en las fábricas que producen papel. Esto ocurre como un producto secundario durante el proceso de pulpeo Kraft.
Dimetilsulfuro en el cuerpo humano
El dimetilsulfuro se encuentra en cantidades muy pequeñas en personas sanas. Por ejemplo, en la sangre, la orina y el aliento.
Cuando hay niveles muy altos de dimetilsulfuro, puede causar un olor desagradable en el aliento. Esto puede ocurrir en personas con ciertas enfermedades del hígado.
¿A qué huele el dimetilsulfuro?
El dimetilsulfuro tiene un olor muy particular. A menudo se describe como un olor similar al de la col. Puede ser muy desagradable, incluso en cantidades muy pequeñas.
Algunos estudios sugieren que el olor que se le atribuye al DMS podría ser en realidad de otras sustancias. Por ejemplo, de disulfuros o impurezas. Esto se debe a que el olor del dimetilsulfuro es menos fuerte después de un tratamiento especial.
El dimetilsulfuro también se usa como aditivo alimentario en pequeñas cantidades. Se añade para dar un sabor salado. Al cocinar remolacha, espárragos, col, maíz y mariscos, se produce dimetilsulfuro.
Usos importantes del dimetilsulfuro
El dimetilsulfuro es el tioéter más importante que se produce en la industria. Uno de sus usos principales es para fabricar dimetilsulfuro de borano. Esto se hace a partir del diborano:
B
2H
6 + 2 (CH
3)
2S → 2 BH
3(S(CH
3)
2)
Cuando el dimetilsulfuro se oxida, se convierte en el disolvente dimetilsulfóxido. Si se oxida aún más, produce la dimetilsulfona.
Reacciones químicas del dimetilsulfuro
El dimetilsulfuro es una base de Lewis. Esto significa que puede donar electrones. Se considera un ligando blando. Forma complejos con muchos metales, pero estos complejos no suelen ser muy estables. Por ejemplo, puede unirse al oro en el cloro(dimetilsulfuro)oro(I).
El dimetilsulfuro se usa en un proceso llamado ozonólisis de los alquenos. En este proceso, ayuda a reducir una sustancia intermedia. También se produce dimetilsulfuro en la oxidación de Swern, a partir del dimetilsulfóxido.
Cuando el dimetilsulfuro reacciona con agentes como el cloruro de sulfurilo, se transforma en clorodimetilsulfuro:
SO
2Cl
2 + (CH
3)
2S → SO
2 + HCl + (ClCH
2)(CH
3)S
Al igual que otros compuestos con metiltio, el DMS puede perder un protón. Esto ocurre gracias a una sustancia llamada butil-litio:
BuLi + (CH
3)
2S → BuH + (LiCH
2)(CH
3)S
Seguridad al usar dimetilsulfuro
El dimetilsulfuro es muy inflamable. Puede irritar los ojos y la piel. Es perjudicial si se ingiere. Su olor es desagradable, incluso en cantidades muy pequeñas. La temperatura a la que puede arder es de 205 °C.
Dimetilsulfuro y el espacio
En septiembre de 2023, el telescopio espacial James Webb encontró rastros de dimetilsulfuro en un exoplaneta llamado K2-18b. Este descubrimiento es emocionante porque este gas se relaciona con la vida. Se espera que futuras observaciones confirmen su presencia.
Galería de imágenes
Ver también
- Coccolithophoridae, un tipo de alga marina que produce DMS.
- Dimetilsulfoniopropionato, la molécula de la que se forma el DMS en los océanos.
- Emiliania huxleyi, un cocolitofórido que produce DMS.
- Oxidación de Swern
- Hipótesis Gaia
- Geosmina, la sustancia que causa el olor a tierra.
- Petricor, el olor a «tierra mojada» después de la lluvia.
Véase también
 En inglés: Dimethyl sulfide Facts for Kids
En inglés: Dimethyl sulfide Facts for Kids