Ácido peryódico para niños
Datos para niños
Ácido peryódico |
||
|---|---|---|
 |
||
| Nombre IUPAC | ||
| Hidrógeno(tetraoxidoyodato) o hidroxidotrioxidoyodo | ||
| General | ||
| Otros nombres | Ácido peryódico | |
| Fórmula estructural | Estructura en Jmol | |
| Fórmula molecular | HIO4 | |
| Identificadores | ||
| Número CAS | 10450-60-9 | |
| ChEBI | 29149 | |
| ChemSpider | 58684 | |
| PubChem | 65185 | |
|
InChI
InChI=InChI=1S/H5IO6/c2-1(3,4,5,6)7/h(H5,2,3,4,5,6,7)
Key: TWLXDPFBEPBAQB-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Cristales incoloros | |
| Masa molar | 191,91 g/mol | |
| Punto de fusión | 395 K (122 °C) | |
| Peligrosidad | ||
| NFPA 704 |
0
3
2
OX
|
|
| Frases R | R8 R34 | |
| Frases S | S26 S36/37/39 S45 | |
| Riesgos | ||
| Ingestión | No inducir vómito, enjuagar con abundante agua, atención médica. | |
| Inhalación | Extremadamente destructivo para el tejido de las membranas mucosas y tracto respiratorio superior. Dar aire fresco, respiración artificial si es necesaria, atención médica. | |
| Piel | Quemaduras. Quitar ropa contaminada y zapatos inmediatamente, lavar con jabón y abundante agua, atención médica. | |
| Ojos | Quemaduras. Enjuagar los ojos durante el trayecto al hospital, enjuagar cuidadosamente con abundante agua por al menos 15 minutos, atención médica. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
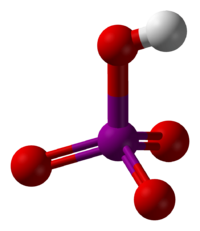
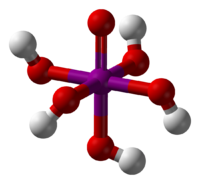
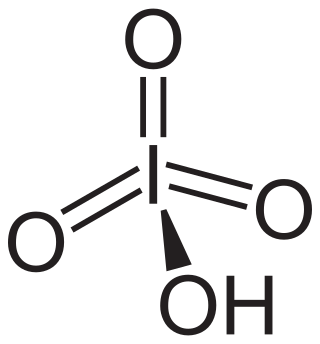
El ácido peryódico es un tipo de ácido que contiene yodo y oxígeno. Se le conoce también como ácido yódico (VII). Este ácido puede presentarse de dos formas principales, cada una con una fórmula química diferente: HIO4 (llamado ácido metaperyódico) o H5IO6 (conocido como ácido ortoperyódico).
Contenido
¿Qué es el Ácido Peryódico?
El ácido peryódico es un compuesto químico importante en el estudio de la química. Es un oxácido, lo que significa que es un ácido que contiene oxígeno. Su elemento central es el yodo, que se combina con el oxígeno y el hidrógeno para formar estas estructuras ácidas.
Sus Diferentes Formas
El ácido peryódico puede existir en dos formas principales, dependiendo de cómo se organizan sus átomos.
- Ácido Metaperyódico (HIO4): Esta forma es más común cuando el ácido peryódico está muy diluido en agua. En esta situación, se separa en pequeñas partículas cargadas llamadas iones, específicamente iones hidronio (H3O+) y metaperyodato (IO4−).
- Ácido Ortoperiódico (H5IO6): Cuando la solución es más concentrada, se forma esta otra versión. También se separa en iones, pero esta vez son iones hidronio y ortoperyodato (IO65−).
Ambas formas pueden transformarse una en la otra en una solución acuosa. Esto ocurre en un equilibrio químico, lo que significa que las dos formas coexisten y se convierten constantemente entre sí, dependiendo de la acidez o pH de la solución.
- IO4− + 6 H2O
 IO65− + 4 H3O+
IO65− + 4 H3O+
¿Cómo se Obtiene el Ácido Peryódico?
El ácido ortoperyódico se puede obtener como un sólido con forma de cristales. Si se calienta este sólido, se le puede quitar agua (un proceso llamado deshidratación) para obtener el ácido metaperyódico (HIO4).
Si se calienta aún más, el ácido se descompone. En lugar de formar el compuesto de yodo y oxígeno que se esperaría, produce pentóxido de diyodo (I2O5) y oxígeno. El compuesto esperado, llamado heptóxido de diyodo, no se encuentra en la naturaleza, pero los científicos pueden crearlo en un laboratorio.
Sales de Peryodato
Dado que existen dos formas de ácido peryódico, también se forman dos tipos de sales de peryodato. Por ejemplo:
- El metaperyodato de sodio (NaIO4) se puede crear a partir del ácido metaperyódico (HIO4).
- El ortoperyodato de sodio (Na5IO6) se puede crear a partir del ácido ortoperyódico (H5IO6).
Las sales de metaperyodato son similares a las sales de perclorato en cómo se disuelven y en sus propiedades químicas. Sin embargo, los iones de peryodato son más grandes y son menos "oxidantes" que los percloratos. Ser oxidante significa que pueden hacer que otras sustancias reaccionen con el oxígeno.
¿Para Qué se Usa el Ácido Peryódico?
El ácido peryódico es una herramienta muy útil en la química orgánica, que es el estudio de los compuestos que contienen carbono. Se utiliza para el análisis estructural, lo que significa que ayuda a los científicos a descubrir cómo están organizadas las moléculas.
Una de sus aplicaciones más importantes es en el estudio de los carbohidratos (como los azúcares y el almidón). El ácido peryódico puede romper ciertas partes de las moléculas de carbohidratos, específicamente los dioles vecinales. Al romper estas partes, se forman fragmentos más pequeños, como aldehídos o cetonas. Observar estos fragmentos ayuda a los químicos a entender la estructura original del carbohidrato.
Véase también
 En inglés: Periodic acid Facts for Kids
En inglés: Periodic acid Facts for Kids