Sulfuro de plomo(II) para niños
Datos para niños
Sulfuro de plomo(II) |
||
|---|---|---|
 Un trozo de galena, un mineral cuya composición química es sulfuro de plomo(II).
|
||
 |
||
| Nombre IUPAC | ||
| Sulfuro de plomo(II) | ||
| General | ||
| Otros nombres | Sulfuro plumboso, galena | |
| Fórmula molecular | PbS | |
| Identificadores | ||
| Número CAS | 1314-87-0 | |
| ChemSpider | 14135 | |
| PubChem | 14819 | |
|
InChI
InChI=InChI=1S/Pb.S
Key: XCAUINMIESBTBL-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | color negro o plateado si está cristalizado (galena). | |
| Densidad | 7700 kg/m³; 77 g/cm³ | |
| Masa molar | 239,28 g/mol | |
| Punto de fusión | 1386,1 K (1113 °C) | |
| Punto de ebullición | 1554,3 K (1281 °C) | |
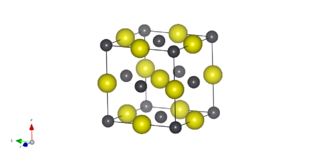
| Estructura cristalina | cúbico tipo NaCl | |
| Propiedades químicas | ||
| Solubilidad en agua | insoluble en agua | |
| Producto de solubilidad | 1,3 x 10-28 | |
| Termoquímica | ||
| ΔfH0gas | 131,80 kJ/mol | |
| ΔfH0líquido | -84,06 kJ/mol | |
| ΔfH0sólido | -98,32 kJ/mol | |
| S0gas, 1 bar | 251,41 J·mol–1·K | |
| S0líquido, 1 bar | 100,79 J·mol–1·K–1 | |
| S0sólido | 91,34 J·mol–1·K–1 | |
| Peligrosidad | ||
| Frases R | R 20/22 gas Perjudicial si es inhalado o ingerido. R 33 Peligro de efectos acumulativos. R 50/53 Muy tóxico para organismos acuáticos, puede causar efectos adversos a largo plazo sobre el medio ambiente acuático. |
|
| Frases S | S 45 En caso de accidente o sensación de malestar, acuda al médico inmediatamente y muéstrele la etiqueta si es posible. S 53 Evite la exposición al producto. Lea las instrucciones especiales antes de su uso. S 60 Esta sustancia y su envase puede considerarse como residuo peligroso. S 61 Evite la difusión al medio ambiente. Cumpla las instrucciones especiales de las hojas de seguridad. |
|
| Riesgos | ||
| Ingestión | Causa irritación gastrointestinal con náusea, vómitos y diarrea. | |
| Inhalación | Causa irritación del tracto respiratorio. | |
| Piel | Irritación de la piel. | |
| Ojos | Irritación y molestias visuales. | |
| Más información | Muchos compuestos de plomo pueden causar efectos perjudiciales en la sangre, los riñones y el sistema nervioso. La exposición continua al plomo puede llevar a una enfermedad que afecta el cuerpo y la mente. | |
| Compuestos relacionados | ||
| Otros aniones | cloruro de plomo(II) óxido de plomo(II) seleniuro de plomo(II) telururo de plomo(II) |
|
| Otros cationes | sulfuro de estaño(II) sulfuro de hierro(II) sulfuro de cobre(II) sulfuro de potasio |
|
| Otros compuestos de Pb y S | sulfuro de plomo(IV) sulfato de plomo(IV) sulfito de plomo(II) sulfato de plomo(II) |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El sulfuro de plomo(II) es una sustancia química de color oscuro. También se le conoce como sulfuro plumboso. No se disuelve en agua ni en ácidos suaves. Se forma fácilmente cuando otras sales de plomo se mezclan con sulfuros.
Esta reacción es útil en la química analítica. Permite separar el plomo de otros elementos. Esto se hace junto con otros sulfuros que no se disuelven fácilmente.
Contenido
¿Qué es el Sulfuro de Plomo(II)?
El sulfuro de plomo(II) es un compuesto químico. Está formado por plomo (Pb) y azufre (S). Su fórmula química es PbS.
¿Cómo se obtiene el Sulfuro de Plomo(II)?
El sulfuro de plomo(II) se encuentra en la naturaleza. Se extrae de un mineral llamado galena. La galena tiene la misma composición química. Es la fuente principal para obtener plomo y otros compuestos de este metal.
En un laboratorio, se puede crear sulfuro de plomo(II). Para ello, se usa una solución de plomo(II). A esta solución se le añade ácido sulfhídrico o una solución de un sulfuro que sí se disuelve, como el sulfuro de sodio.
Usos y aplicaciones del Sulfuro de Plomo(II)
El sulfuro de plomo(II) tiene varias aplicaciones importantes.
La galena y la extracción de plomo
La galena es el mineral más importante para obtener plomo. A veces, la galena contiene impurezas de plata. En esos casos, se extrae principalmente la plata.
Para obtener plomo del sulfuro de plomo(II), se calienta al aire. El sulfuro se combina con el oxígeno. Esto produce dióxido de azufre y óxido de plomo(II) (PbO).
2 PbS + 3 O2 → 2 PbO + 2 SO2
Luego, el óxido de plomo(II) se puede mezclar con carbono. Al calentarlo, se obtiene plomo puro.
2 PbO + C → 2 Pb + CO2
También se puede calentar el óxido de plomo(II) con la cantidad justa de sulfuro de plomo(II). En este caso, el sulfuro de plomo(II) ayuda a obtener el plomo.
2 PbO + PbS → 3 Pb + SO2
El dióxido de azufre que se forma en estos procesos puede usarse. Es un ingrediente para fabricar ácido sulfúrico (H2SO4).
En el pasado, estos procesos causaban mucha contaminación en el ambiente.
Usos en la tecnología
El sulfuro de plomo tiene propiedades de semiconductor. Esto significa que puede conducir la electricidad bajo ciertas condiciones.
Algunos de los primeros aparatos de radio, llamados radios de galena, usaban cristales de galena natural. Funcionaban como un diodo, un componente electrónico.
Hoy en día, el sulfuro de plomo se usa en detectores de radiación infrarroja. Estos detectores se llaman detectores de fotones. Responden directamente a la luz infrarroja. Otros detectores, llamados térmicos, solo reaccionan a los cambios de temperatura.
El sulfuro de plomo también se usa en algunos esmaltes para cerámica. Cuando se hornea, se convierte en óxido de plomo(II). Este óxido forma una capa brillante sobre la pieza de cerámica. Sin embargo, si la cerámica entra en contacto con ácidos, el plomo puede liberarse. Por eso, hoy en día se usan esmaltes más seguros.
Precauciones importantes
El sulfuro de plomo y otros compuestos de plomo deben manejarse con cuidado. Si se ingiere, puede causar malestar estomacal. Si se inhala, puede irritar las vías respiratorias. También puede irritar la piel y los ojos.
La exposición continua al plomo puede ser perjudicial. Puede afectar partes importantes del cuerpo como la sangre, los riñones y el sistema nervioso. Es importante evitar el contacto con esta sustancia.
Véase también
 En inglés: Lead(II) sulfide Facts for Kids
En inglés: Lead(II) sulfide Facts for Kids

