Dióxido de estaño para niños
Datos para niños
Dióxido de estaño |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Dióxido de estaño | ||
| General | ||
| Otros nombres | Óxido estánico Óxido de estaño (IV) Flores de estaño Casiterita |
|
| Fórmula molecular | SnO2 | |
| Identificadores | ||
| Número CAS | 18282-10-5 | |
| Número RTECS | XQ4000000 | |
| PubChem | 29011 | |
|
InChI
InChI=InChI=1S/2O.Sn
Key: XOLBLPGZBRYERU-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | polvo blanco | |
| Densidad | 6950 kg/m³; 6,95 g/cm³ | |
| Masa molar | 150,709 g/mol | |
| Punto de fusión | 1630 °C (1903 K) | |
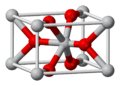
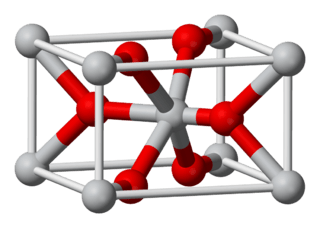
| Estructura cristalina | Rutilo (tetragonal), tP6 | |
| Índice de refracción (nD) | 2.006 | |
| Propiedades químicas | ||
| Solubilidad en agua | insoluble | |
| Termoquímica | ||
| ΔfH0gas | −581 kJ/mol | |
| S0gas, 1 bar | 52 J·mol–1·K | |
| Peligrosidad | ||
| NFPA 704 |
0
2
0
|
|
| Compuestos relacionados | ||
| Otros aniones | Estaño disulfuro | |
| Otros cationes | Dióxido de carbono Óxido de silicio (IV) Óxido de titanio (IV) Dióxido de germanio Dióxido de zirconio Óxido de hafnio (IV) Dióxido de plomo |
|
| Óxidos de estaño relacionados | Óxido de estaño (II) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El dióxido de estaño es un compuesto inorgánico con la fórmula SnO2. Es un material muy importante en la química del estaño. La forma natural de este compuesto se llama casiterita. La casiterita es el mineral principal del estaño. El dióxido de estaño es un sólido incoloro que no es magnético y tiene propiedades especiales que le permiten reaccionar tanto con ácidos como con álcalis.
Contenido
¿Cómo se forma el dióxido de estaño?
El dióxido de estaño se encuentra en la naturaleza. Para obtenerlo puro, se reduce el mineral a estaño metálico. Luego, este estaño se quema en el aire. Cada año se producen miles de toneladas de dióxido de estaño.
Producción industrial
En la industria, el SnO2 se obtiene mezclando estaño metálico con carbono. Esta mezcla se calienta en un horno especial a temperaturas muy altas, entre 1200 y 1300 grados Celsius.
Preparación en el laboratorio
En un laboratorio, se puede obtener dióxido de estaño haciendo reaccionar estaño sólido con ácido nítrico. Esta reacción produce dióxido de estaño, un gas llamado dióxido de nitrógeno y agua.
- Sn(s) + 4HNO3(aq) → SnO2(s) + 4NO2(g) + 2H2O(l)
Propiedades y estructura del dióxido de estaño
El dióxido de estaño tiene una estructura cristalina similar a la del rutilo. En esta estructura, cada átomo de estaño está rodeado por seis átomos de oxígeno. A su vez, cada átomo de oxígeno está unido a tres átomos de estaño. Se considera un semiconductor de tipo n, lo que significa que puede conducir electricidad bajo ciertas condiciones.
¿Es soluble en agua?
Aunque el dióxido de estaño no se disuelve en agua, tiene una propiedad interesante: es un óxido que puede reaccionar tanto con ácidos como con álcalis (bases fuertes). A esta propiedad se le llama anfótero. La casiterita, que es el mineral de dióxido de estaño, es difícil de disolver en ácidos y álcalis.
- Los ácidos fuertes, como los ácido halógenos, pueden disolver el SnO2. Por ejemplo, con HI, se forma H2SnI6.
- También se disuelve en ácido sulfúrico para formar sulfato de estaño.
- Con bases fuertes, como el hidróxido de sodio (NaOH), forma compuestos llamados "estanatos".
Usos importantes del dióxido de estaño
El dióxido de estaño se utiliza en muchas aplicaciones diferentes:
- En la cerámica: Se usa para hacer que los esmaltes cerámicos sean opacos y de color blanco. Esto es común en azulejos, sanitarios y paredes. El SnO2 se mantiene en el esmalte y, debido a su alto índice de refracción, dispersa la luz, haciendo que el esmalte no sea transparente.
- Como catalizador: Combinado con otros óxidos, como los de vanadio, se usa para acelerar reacciones químicas. Por ejemplo, en la producción de ácidos carboxílicos.
- En sensores: Los hilos de SnO2 son un componente clave en los detectores de monóxido de carbono. Ayudan a detectar este gas peligroso.
- Recubrimientos protectores: Se aplica en capas delgadas sobre botellas de vidrio. Esta capa de SnO2 ayuda a que un recubrimiento protector de polietileno se adhiera mejor al vidrio.
- En dispositivos electrónicos: Capas más gruesas de SnO2, a las que se les añaden iones de antimonio o flúor, pueden conducir electricidad. Se usan en dispositivos que emiten luz.
- Como pigmento: El SnO2 puro da un color blanco lechoso. Si se mezcla con otros óxidos metálicos, puede crear diferentes colores:
- Con V2O5 da un color amarillo.
- Con Cr2O3 da un color rosa.
- Con Sb2O5 da un color gris azulado.
Galería de imágenes
Véase también
 En inglés: Tin(IV) oxide Facts for Kids
En inglés: Tin(IV) oxide Facts for Kids