Terapia génica para niños
La terapia génica es un método especial que busca tratar enfermedades en las personas. Se basa en introducir material genético, como partes de ADN, en las células de un individuo.
El objetivo de esta técnica es arreglar una función celular que no estaba funcionando bien, añadir una nueva función a las células o detener una función que está causando problemas. Para lograr esto, la terapia génica combina tres cosas importantes: el material genético que se va a usar, la forma en que se introduce en las células y el tipo de células que recibirán ese material.
Al principio, la terapia génica se enfocó en tratar enfermedades hereditarias causadas por un solo gen. Sin embargo, la mayoría de los estudios actuales se han dirigido al tratamiento del cáncer. La terapia génica en humanos es posible y puede ser muy útil, pero las herramientas y técnicas necesitan mejorar para que se convierta en un tratamiento común.
Contenido
- ¿Para qué se usa la terapia génica?
- Tipos de terapia génica: ¿Dónde se aplica?
- ¿Cómo funciona la terapia génica?
- Vehículos en terapia génica
- Células objetivo: ¿A qué células queremos llegar?
- Momentos clave en la historia de la terapia génica
- Enfermedades y terapia génica
- Desafíos de la terapia génica
- Terapia génica en otros animales
- Terapia génica en la cultura popular
- Galería de imágenes
- Véase también
¿Para qué se usa la terapia génica?
La terapia génica tiene varias aplicaciones importantes:
Marcaje genético: ¿Cómo rastreamos las células?
El marcaje genético no busca curar al paciente, sino seguir el rastro de ciertas células en el cuerpo. Esto ayuda a saber si esas células específicas están presentes en un lugar determinado. Por ejemplo, en pacientes con ciertos tipos de cáncer a quienes se les ha hecho un trasplante, esta técnica permite saber si las células que se recuperan son las trasplantadas o si son células propias que sobrevivieron al tratamiento.
Tratamiento de enfermedades hereditarias: Cuando un gen no funciona bien
Se utiliza en enfermedades hereditarias donde falta una proteína o no funciona correctamente, y no es fácil o efectivo dar esa proteína directamente. En estos casos, la terapia génica introduce el gen que está defectuoso o ausente.
Tratamiento de enfermedades adquiridas: El caso del cáncer
Entre las enfermedades adquiridas, el cáncer es una de las más importantes para la terapia génica. Se usan diferentes estrategias, como introducir genes especiales en las células tumorales para que estas se autodestruyan, o añadir sustancias que ayuden al sistema inmunitario del cuerpo a reconocer y atacar las células con problemas.
Tipos de terapia génica: ¿Dónde se aplica?
Terapia génica somática: Solo para el paciente
Esta terapia se realiza en las células somáticas de una persona, lo que significa que los cambios solo afectan a ese paciente y no se transmiten a sus hijos.
- Terapia in vivo: Dentro del cuerpo
En este caso, la modificación de las células ocurre dentro del paciente. Se le administra el gen a través de un "vehículo" (como un virus modificado), que debe encontrar las células a las que necesita llegar. El desafío es lograr que este vehículo llegue solo a las células específicas que se quieren tratar.
- Terapia ex vivo: Fuera del cuerpo
Aquí, las células se extraen del paciente (por ejemplo, con una pequeña muestra de tejido), se modifican en un laboratorio y luego se vuelven a introducir en el paciente. Como se hace fuera del cuerpo, es más fácil de controlar. Esta técnica se usa mucho con células de la sangre, ya que son fáciles de cultivar y trasplantar.
Terapia génica germinal: ¿Se hereda?
Este tipo de terapia se haría en las células germinales (las que dan origen a los óvulos o espermatozoides), lo que significaría que los cambios genéticos serían hereditarios. Sin embargo, por razones éticas y legales, este tipo de terapia no se realiza hoy en día.
¿Cómo funciona la terapia génica?
En la mayoría de los estudios de terapia génica, se introduce una copia de un gen que funciona correctamente en el material genético de las células para compensar uno defectuoso. Si solo se añade esta copia, se llama terapia génica de adición. Si se busca reemplazar el gen defectuoso por uno funcional, se llama terapia de sustitución.
Actualmente, los "vehículos" más comunes para introducir genes son los virus, que se modifican genéticamente para que no causen enfermedades y puedan llevar los genes deseados. También existen otros tipos de vehículos no virales. El ADN también se puede introducir con métodos físicos, como la electroporación (usando electricidad) o la biobalística (disparando partículas recubiertas de ADN).
Si se conoce la secuencia de ADN que está defectuosa en el paciente, se puede usar un tipo de enzimas llamadas endonucleasas de restricción. Estas enzimas pueden reconocer genes específicos, cortarlos y luego introducir el material genético correcto para que el gen funcione bien. Aunque suena complicado, el proceso es más sencillo de lo que parece si se conoce la secuencia incorrecta y se usa la enzima adecuada.
Una vez que el ADN está dentro de la célula huésped, se "lee" y se convierte en una proteína funcional. Esta proteína realizará su función y, en teoría, corregirá el problema que causaba la enfermedad.
Una nueva y prometedora dirección es la creación de materiales activados por genes. Esto combina la ingeniería de tejidos con la terapia génica. Un vehículo que lleva el código para una proteína específica se une a un material compatible con el cuerpo. Después de implantarlo, este material sirve como base temporal para formar tejido nuevo, y el vehículo hace que las células cercanas empiecen a producir la proteína deseada en el lugar de la implantación.
Vehículos en terapia génica
No existe un solo tipo de "vehículo" o vector que sea perfecto para todas las situaciones de terapia génica. Sin embargo, un vector ideal debería tener estas características:
- Ser fácil de reproducir.
- Ser estable.
- Permitir la inserción de material genético de cualquier tamaño.
- Poder introducir genes tanto en células que se dividen como en las que no.
- Permitir que el gen se integre en un lugar específico del material genético.
- Integrarse solo una vez por célula para controlar la cantidad.
- Reconocer y actuar solo sobre las células específicas.
- Permitir regular la actividad del gen.
- No causar una respuesta del sistema inmunitario.
- Ser fácil de estudiar y entender completamente.
- Ser seguro o tener efectos secundarios mínimos.
- Ser fácil de producir y almacenar.
- Tener un costo razonable.
Los vehículos no solo llevan los genes funcionales, sino también elementos necesarios para que esos genes se activen y se regulen, como los promotores o potenciadores.
Existen dos categorías principales de vehículos: los virales y los no virales.
Virus: Vehículos naturales
Todos los virus tienen la capacidad de introducir su material genético en las células para multiplicarse. Algunos virus insertan sus genes en el material genético de la célula, otros pasan por diferentes partes de la célula, y otros se multiplican directamente en el citoplasma. El tipo de virus que se usa depende de la terapia que se quiera realizar.
Para usar virus en terapia génica, a menudo se necesitan "líneas celulares empaquetadoras" o "virus ayudantes" que llevan los genes que se eliminaron de los vectores para permitir la infección.
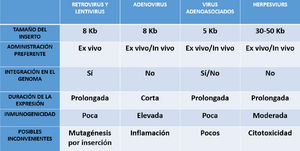
Retrovirus
Los retrovirus tienen un material genético de ARN. Cuando infectan una célula, introducen su ARN junto con algunas enzimas. Una de estas enzimas, la transcriptasa inversa, crea una copia de ADN a partir del ARN del virus. Luego, otra enzima, la integrasa, introduce este ADN en el material genético de la célula huésped.
Para usar retrovirus como vehículos en terapia génica, se les quitan los genes que les permiten replicarse y se reemplazan por el gen que se quiere introducir, junto con un gen marcador.
Un problema de los retrovirus es que la enzima integrasa puede insertar el material genético en cualquier parte del material genético de la célula, lo que podría causar problemas como cambiar la forma en que otros genes se activan o causar nuevas mutaciones.
A pesar de esto, los ensayos de terapia génica con retrovirus para tratar una enfermedad del sistema inmunitario llamada inmunodeficiencia combinada grave ligada al cromosoma X (X-SCID) han sido muy exitosos. Muchos pacientes han sido tratados y han mejorado su sistema inmunitario. Sin embargo, en algunos casos, se ha reportado la aparición de leucemia en pacientes, lo que llevó a detener temporalmente algunos estudios. Actualmente, la terapia génica para tratar SCID sigue siendo exitosa en varios países.
Adenovirus
Los adenovirus tienen un material genético de ADN de doble cadena y no lo integran en el material genético de la célula huésped. En cambio, el ADN del virus permanece libre en el núcleo de la célula y se activa de forma independiente. Esto significa que no causan los problemas de inserción que tienen los retrovirus. Además, pueden infectar tanto células que se dividen como las que no.
Los primeros vehículos basados en adenovirus tenían algunos genes eliminados. Los más recientes casi no tienen genes virales, excepto las partes necesarias para su empaquetamiento. Esto ayuda a reducir la respuesta del sistema inmunitario del cuerpo.
Virus Adenoasociados (AAV)
Los AAV son virus pequeños con un material genético de ADN de una sola cadena. Pueden integrarse de forma específica en el cromosoma 19 con alta probabilidad. Sin embargo, los AAV modificados que se usan como vehículos y que no contienen genes virales, solo el gen terapéutico, no se integran en el material genético. En su lugar, el material genético modificado del virus se une por sus extremos, formando estructuras circulares que se cree que permiten que el gen se active por mucho tiempo.
Las desventajas de los sistemas basados en AAV son que solo pueden llevar una cantidad muy pequeña de ADN y que su producción e infección son complejas. Sin embargo, como no suelen causar enfermedades, la mayoría de los pacientes tratados no tienen una respuesta del sistema inmunitario para eliminarlos.
Muchos estudios con AAV se están realizando o preparando, especialmente para tratar enfermedades musculares y oculares, donde estos virus parecen ser muy útiles. También se están empezando a usar para introducir genes en el cerebro, ya que pueden infectar células que no se dividen, como las neuronas.
Herpes virus
Los herpesvirus son virus de ADN que pueden permanecer "dormidos" en las células huésped. Son complejos, pero como vehículos tienen la ventaja de poder llevar grandes fragmentos de ADN (hasta 30 veces más que otros virus). Además, aunque se multiplican en el lugar de la infección, se quedan "dormidos" en las neuronas, que son importantes en muchas enfermedades del sistema nervioso.
Se han usado dos estrategias principales para los vehículos basados en herpesvirus:
- Combinar el material genético del virus completo con un plásmido que lleva el gen deseado en una zona que no es esencial para la replicación del virus.
- Usar vehículos con partes del virus necesarias para su replicación y empaquetamiento, y producirlos en células especiales que aportan el resto de los genes del virus.
Sin embargo, los vehículos basados en el HSV (virus del herpes simple) solo se pueden usar en pacientes que no hayan sido infectados previamente por este virus, ya que podrían tener inmunidad.
Modificación de proteínas en vehículos virales
Los vehículos virales que hemos visto tienen células huésped naturales que infectan eficientemente. Pero algunos tipos de células no son fáciles de infectar por estos virus.
La entrada del virus a la célula depende de proteínas en su superficie. Estas proteínas interactúan con receptores en la superficie de la célula, lo que ayuda al virus a entrar.
Para una terapia génica específica, se podría querer limitar o ampliar el rango de células que un vehículo puede infectar. Por eso, se han desarrollado vehículos "pseudotipados", en los que la cubierta de proteínas del virus original se reemplaza por proteínas de otros virus o por proteínas combinadas.
Por ejemplo, un vehículo retroviral muy popular para estudios de terapia génica ha sido el virus de la inmunodeficiencia en simios cubierto con una proteína de otro virus (el virus de la estomatitis vesicular). Este vehículo puede infectar casi todas las células gracias a esa proteína.
Se ha intentado muchas veces limitar la capacidad de los vectores virales para infectar muchas células (su tropismo). Esto permitiría usar una cantidad más pequeña del vehículo. La mayoría de los intentos han usado proteínas combinadas para la cubierta, que incluyen fragmentos de anticuerpos.
Métodos no virales: Sin virus
Estos métodos tienen algunas ventajas sobre los virales, como ser más fáciles de producir en grandes cantidades y causar menos respuesta del sistema inmunitario. Antes, los métodos no virales no eran tan eficientes para introducir genes, pero los avances recientes han creado técnicas y moléculas que son casi tan buenas como los virus.
ADN desnudo
Este es el método no viral más simple. Consiste en aplicar directamente, por ejemplo, un plásmido con ADN "desnudo" (sin cubierta). Algunos estudios han tenido éxito con esto, pero la actividad del gen ha sido muy baja. También se han hecho pruebas con productos de PCR, con resultados similares. Esto ha llevado a buscar métodos más eficientes, como la electroporación, la sonicación (usando ondas de sonido), o la biobalística, que consiste en disparar partículas de oro cubiertas de ADN hacia las células usando altas presiones de gas.
Oligonucleótidos: Pequeñas piezas de ADN
El uso de oligonucleótidos sintéticos en terapia génica busca desactivar los genes que causan una enfermedad.
Hay varias estrategias:
- La terapia "antisentido" usa oligonucleótidos que se unen al ARN del gen problemático, silenciándolo. También puede modificar cómo se "lee" el gen.
- También se usan pequeñas moléculas de ARN de interferencia (ARN dei) para silenciar genes.
- Otra opción es usar oligodesoxinucleótidos como "señuelos" para las proteínas que activan los genes problemáticos. Estas proteínas se unen a los señuelos en lugar de al gen, reduciendo su actividad.
- Además, se han usado oligonucleótidos de ADN de una sola cadena para cambiar una sola base en la secuencia de un gen mutado.
Al igual que los métodos de ADN desnudo, necesitan técnicas especiales para entrar en la célula.
Cromosomas artificiales: Grandes paquetes de información
La creación de cromosomas humanos artificiales (HACs) estables es una posibilidad actual para introducir ADN de forma permanente en células somáticas para tratar enfermedades. Son muy estables y permiten introducir grandes cantidades de información genética.
Lipoplexes y poliplexes: ADN envuelto
El ADN puede ser cubierto por lípidos (grasas) formando estructuras organizadas llamadas lipoplexes.
Hay tres tipos de lípidos: aniónicos, neutros o catiónicos. Al principio se usaban lípidos aniónicos y neutros, pero eran algo tóxicos y difíciles de producir. Por eso, la atención se centró en los lípidos catiónicos. Estos, al tener carga positiva, interactúan con el ADN (que tiene carga negativa), facilitando que el ADN se envuelva en liposomas. Los liposomas catiónicos también interactúan con la membrana de la célula, y se cree que las células los absorben principalmente por endocitosis.
Cuando los genes no pueden salir al citoplasma desde los endosomas (pequeñas bolsas que se forman al entrar en la célula), el ADN se destruye. La eficiencia de este "escape endosomal" es baja con solo lípidos catiónicos, pero mejora mucho si se añaden "lípidos de ayuda". Algunos lípidos pueden desestabilizar la membrana del endosoma. Ciertos compuestos químicos, como la cloroquina, también pueden ayudar al ADN a escapar, pero deben usarse con cuidado porque pueden ser tóxicos.
Sin embargo, los lípidos catiónicos pueden ser tóxicos si se usan en grandes cantidades, lo que limita la dosis.
Los lipoplexes se usan comúnmente para transferir genes a células cancerosas, donde los genes introducidos activan genes que detienen el tumor y reducen la actividad de los genes que lo causan.
Estudios recientes han demostrado que los lipoplexes son útiles en las células del sistema respiratorio, lo que podría servir para tratar enfermedades como la fibrosis quística.
Los complejos de polímeros de ADN se llaman poliplexes y la mayoría están hechos de polímeros catiónicos.
Una diferencia importante es que algunos poliplexes no pueden liberar su ADN al citoplasma, por lo que necesitan ayuda para romper la membrana del endosoma. Otros, como los que usan quitosano o polietilenimina, sí pueden liberarse del endosoma.
Métodos híbridos: Combinando lo mejor
Debido a las limitaciones de muchos sistemas de transferencia de genes, se han desarrollado métodos híbridos que combinan dos o más técnicas. Un ejemplo son los virosomas, que combinan liposomas con virus inactivados como el VIH o el virus de la gripe.
Dendrímeros: Nanomoléculas ramificadas
Un dendrímero es una molécula muy ramificada con forma esférica o variable. Su superficie puede modificarse de muchas maneras, lo que le da propiedades útiles. Además, su tamaño a escala nano permite su uso en biomedicina.
Se pueden construir dendrímeros catiónicos (con carga positiva en la superficie). De esta forma, interactúan con el ácido nucleico (que tiene carga negativa) y forman un complejo que puede entrar en la célula por endocitosis. Esto es útil en terapia génica para introducir genes.
Aunque su producción es costosa, se están desarrollando técnicas para abaratarla, ya que son poco tóxicos y su principal desventaja es el costo de fabricación.
Tabla comparativa de principales vectores virales
Células objetivo: ¿A qué células queremos llegar?
Las células objetivo se eligen según el tipo de tejido donde se necesita que el gen se active. También deben ser células que vivan mucho tiempo, ya que no tiene sentido modificar células que morirán pronto. Además, es importante saber si la célula objetivo se está dividiendo o no, porque algunos vehículos virales, como los retrovirus, solo infectan células en división.
Considerando esto, las células madre serían las ideales, ya que introducir un gen en ellas tendría un efecto a largo plazo. Debido a la experiencia en trasplantes de médula ósea, las células madre hematopoyéticas (las que dan origen a las células de la sangre) son una de las más estudiadas. La terapia génica en estas células es posible y son muy adecuadas para la transferencia ex vivo. Otras células objetivo con las que se ha trabajado son:
- Linfocitos: Son células que viven mucho tiempo y son fáciles de obtener (están en la sangre). Son un objetivo para terapias ex vivo en casos de melanomas e inmunodeficiencias.
- Epitelio respiratorio: Son células que se dividen muy lentamente y no se pueden modificar ex vivo, pero sí con adenovirus y lipoplexes.
- Hepatocitos (células del hígado): Se pueden modificar tanto ex vivo (cultivándolas y trasplantándolas) como in vivo (se están desarrollando receptores específicos para ellas).
- Fibroblastos dérmicos (células de la piel): Son fáciles de obtener y cultivar, y se pueden modificar tanto ex vivo como in vivo, pero sus efectos suelen ser temporales.
- Células musculares: Se pueden modificar inyectando ADN directamente o usando adenovirus, aunque con éxito limitado en este último caso.
Momentos clave en la historia de la terapia génica
Antes de 2002
La terapia génica comenzó a desarrollarse en la década de 1970 para tratar enfermedades genéticas. Los primeros intentos con virus no tuvieron éxito. En la década de 1980, se intentó tratar la talasemia con betaglobina, lo cual funcionó en animales, pero no se pudo aplicar en humanos.
En 1990, W. French Anderson propuso usar células de la médula ósea tratadas con un vehículo retroviral que llevaba una copia correcta del gen de la enzima adenosina desaminasa, que está mutada en una enfermedad del sistema inmunitario llamada SCID. Se modificaron los linfocitos T del paciente fuera del cuerpo y luego se reintrodujeron. Cinco años después, los resultados mostraron el potencial de esta técnica.
Sin embargo, el apoyo a la terapia se vio afectado cuando algunos niños tratados para SCID desarrollaron leucemia. Los estudios clínicos se detuvieron temporalmente en 2002 debido al caso de Jesse Gelsinger, la primera persona reconocida públicamente que falleció a causa de la terapia génica. Su fallecimiento se debió a una respuesta excesiva del sistema inmunitario a un vehículo adenoviral, lo que causó fallos en varios órganos. En 2002, otros cuatro estudios de terapia génica se paralizaron cuando un niño tratado desarrolló una enfermedad similar a la leucemia. Después de revisar los procedimientos, los proyectos se reanudaron.
2003
Un equipo de investigadores de la Universidad de California, en Los Ángeles, logró introducir genes en el cerebro usando liposomas cubiertos con un polímero llamado polietilenglicol (PEG). Introducir genes en el cerebro es un gran avance porque los vehículos virales suelen ser demasiado grandes para cruzar la barrera hematoencefálica (una protección natural del cerebro). Este método tiene potencial para tratar enfermedades como el Parkinson.
Ese mismo año, se propuso usar la interferencia por ARN para tratar la enfermedad de Huntington.
2006
Científicos del NIH trataron con éxito un melanoma avanzado en dos pacientes, usando células T para atacar las células con problemas. Este estudio fue la primera demostración de que la terapia génica puede ser un tratamiento efectivo contra el cáncer.
En marzo de 2006, un grupo internacional de científicos anunció el uso exitoso de la terapia génica para tratar a dos adultos con una enfermedad que afecta las células mieloides. Este estudio, publicado en Nature Medicine, fue pionero en mostrar que la terapia génica puede curar enfermedades del sistema mieloide.
En mayo de 2006, un equipo de científicos en Milán, Italia, informó sobre el desarrollo de una forma de evitar que el sistema inmunitario rechace la entrada de genes. Descubrieron que se podía usar la función natural de los microARN para desactivar selectivamente los genes terapéuticos en las células del sistema inmunológico. Este trabajo es importante para el tratamiento de la hemofilia y otras enfermedades genéticas.
En noviembre del mismo año, se informó sobre VRX496, una inmunoterapia para el tratamiento de un virus que afecta el sistema inmune, que usa un vehículo lentiviral para llevar un ADN antisentido. Fue la primera terapia con un vehículo lentiviral aprobada para estudios clínicos.
2007
El 1 de mayo de 2007, un hospital y una universidad en Londres, y un año después el Hospital de Niños de Filadelfia, anunciaron el primer estudio de terapia génica para una enfermedad hereditaria de la retina. La primera operación (en Inglaterra) se realizó en un joven británico de 23 años. En Filadelfia, Corey Haas fue el primer niño en recibir este tratamiento. La Amaurosis congénita de Leber es una enfermedad hereditaria que causa ceguera por mutaciones en el gen RPE65. Los resultados mostraron que los pacientes mejoraron su visión y no tuvieron efectos secundarios aparentes. Los estudios clínicos de esta terapia están en fase II.
2008
Investigadores de la Universidad de Míchigan en Ann Arbor (Estados Unidos) desarrollaron una terapia genética que ralentiza y ayuda a recuperar las encías afectadas por la enfermedad periodontal, la principal causa de pérdida de dientes en adultos. Descubrieron una forma de ayudar a ciertas células a producir más de una proteína llamada receptor TNF, que se encuentra en bajas cantidades en pacientes con periodontitis. Esta proteína ayuda a reducir los niveles excesivos de TNF, una sustancia que empeora la destrucción ósea en pacientes con artritis y periodontitis. Los resultados mostraron que entre el 60 y el 80 por ciento de los tejidos periodontales se protegían de la destrucción con esta terapia génica.
2009
En septiembre de 2009, se publicó en Nature que investigadores de la Universidad de Washington y la Universidad de Florida lograron dar visión tricromática (ver tres colores) a monos ardilla usando terapia génica.
En noviembre de ese mismo año, la revista Science publicó resultados prometedores sobre el uso de terapia génica en una enfermedad cerebral muy grave, la adrenoleucodistrofia, usando un vehículo retroviral.
2012
El 2 de noviembre, la Comisión Europea autorizó a Glybera, una empresa alemana, a lanzar un tratamiento para un trastorno genético raro: la deficiencia de lipoproteinlipasa (LPL).
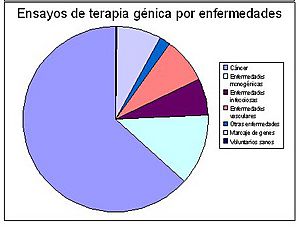
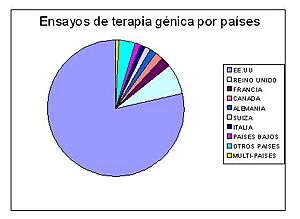
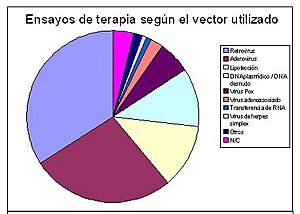
Porcentajes de estudios de terapia génica en la actualidad
Enfermedades y terapia génica
Muchas enfermedades son objeto de la terapia génica. Aquí se destacan algunas:
Hemofilia A
Valoctocogén roxaparvovec es una terapia génica para la hemofilia A grave. Fue aprobada por la Agencia Europea de Medicamentos en agosto de 2022 y por la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) en junio de 2023.
Anemia de células falciformes
Exagamglogene autotemcel es una terapia génica para la anemia de células falciformes grave. Se vende con el nombre Casgevy. Fue aprobada por la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) en diciembre de 2023 y por la Agencia Europea de Medicamentos en febrero de 2024.
Deficiencia de ADA
El primer tratamiento clínico aprobado por la FDA para terapia génica fue en 1990, para la deficiencia de adenosín deaminasa (ADA), que causa un problema en el sistema inmunitario. Aunque no se logró una curación completa (los pacientes aún necesitan algo de tratamiento externo), sí se pudo reducir a la mitad, y el gen siguió activo incluso después de cuatro años. Esto fue un hito en la historia de los tratamientos.
En 2009, se hizo un nuevo experimento donde se extrajeron células hematopoyéticas de la médula ósea para introducir el gen ADA fuera del cuerpo usando un retrovirus modificado (GIADA). Las células modificadas se reintrodujeron en el paciente. Los resultados fueron exitosos: ninguno de los pacientes desarrolló leucemia (como había ocurrido antes con otros retrovirus). Además, todos los pacientes tuvieron una actividad correcta del gen ADA durante años y un aumento de células sanguíneas. Gracias a esto, 8 de los 9 pacientes no necesitaron tratamiento externo para complementar la terapia génica.
Cáncer
El tratamiento del cáncer tradicionalmente ha implicado destruir las células con problemas usando quimioterapia, radiación o cirugía. Sin embargo, la terapia génica es otra estrategia que, en algunos casos, ha logrado reducir significativamente el tamaño de los tumores sólidos. Los principales métodos que usa la terapia génica en el cáncer son:
- Aumentar la respuesta del sistema inmunitario contra el tumor (terapia inmunogénica). Se basa en la capacidad del sistema inmunitario para atacar el cáncer. Para ello, se introducen sustancias en las células tumorales para que las células inmunitarias puedan reconocerlas. Por ejemplo, se pueden modificar las células tumorales con la proteína CD80, que ayuda a los linfocitos T a potenciar la respuesta inmune.
- Introducir genes que activan sustancias en las células tumorales (terapia de genes suicidas). Consiste en introducir genes solo en las células tumorales (no en las sanas) que las hacen sensibles a ciertas sustancias que, de otro modo, no serían dañinas. Esto lleva a la inserción de enzimas que convierten "sustancias inactivas" en "sustancias que destruyen" las células tumorales que se están multiplicando.
- Normalizar el ciclo celular. Busca desactivar genes mutados que causan cáncer (oncogenes) o reactivar genes que suprimen tumores (antioncogenes) que están inactivos, como el p53. Se han realizado estudios clínicos donde se inyectan retrovirus que activan p53 en células tumorales. El desafío es que se necesitan grandes cantidades de virus para tratar tumores grandes y los retrovirus no siempre son muy eficientes.
- Manipulación de las células de la médula ósea. Se usa principalmente en el tratamiento de problemas de la sangre. Consiste en transferir a las células madre de la sangre genes que las protegen de la quimioterapia o las hacen más sensibles a ella. Por ejemplo, el gen MDR1, estudiado en el cáncer de mama, hace que las células trasplantadas sean más resistentes a altas dosis de quimioterapia.
- Uso de ribozimas y tecnología antisentido. Las ribozimas son moléculas de ARN con actividad que aumentan la destrucción del ARN recién formado, disminuyendo proteínas específicas no deseadas que a veces se asocian con problemas tumorales. La tecnología antisentido usa oligonucleótidos de ARN que se unen a una secuencia genética y pueden bloquear el procesamiento del ARN, impidiendo que se forme la proteína.
- Terapia CAR-T. Esta terapia es reciente y consiste en extraer linfocitos T del paciente, modificarlos genéticamente y luego reintroducirlos. De esta manera, los linfocitos T modificados pueden atacar a linfocitos B problemáticos. En algunos tipos de leucemias o linfomas, los linfocitos B pueden volverse problemáticos debido a la presencia de una sustancia en su superficie llamada CD19. Los linfocitos T normales no los reconocen. Al modificar los linfocitos T del paciente, estos pueden reconocer y destruir los linfocitos B problemáticos, deteniendo el avance del tumor. Hospitales en Madrid y Barcelona ya están aplicando este tipo de terapia.
Síndrome de Wiskott-Aldrich (WAS)
El síndrome de Wiskott-Aldrich (WAS) es una enfermedad hereditaria ligada al cromosoma X, que causa problemas en la piel, en la coagulación de la sangre, infecciones frecuentes, problemas en el sistema inmunitario y una mayor tendencia a desarrollar linfomas y enfermedades autoinmunes. La mayoría de las personas con este síndrome fallecen prematuramente debido a infecciones, hemorragias, cáncer o anemia autoinmune grave. Actualmente, se han realizado tratamientos efectivos con trasplantes de médula ósea o sangre de cordón umbilical de un donante compatible.
En 2010, un estudio mostró mejoras importantes en dos niños con esta enfermedad. La terapia consistió en extraer sus células madre hematopoyéticas y reintroducirlas después de integrar el gen WAS en su material genético. Después de la terapia génica, se detectaron niveles significativos de la proteína WASP en las células del sistema inmunitario de los pacientes. Como resultado, los pacientes tuvieron varias mejoras: uno se recuperó completamente de la anemia autoinmune y el otro redujo sus problemas de piel.
Beta Talasemia
La β-talasemia es una enfermedad genética con cambios en el gen de la β-globulina que reducen o bloquean la producción de esta proteína. Los pacientes con esta enfermedad sufren de anemia grave y necesitan transfusiones de sangre durante toda su vida. La terapia génica busca corregir las células madre de la médula ósea transfiriendo el gen normal de la β-globina a las células madre hematopoyéticas (CMH) para que produzcan glóbulos rojos normales de forma permanente. Para esto, se planea usar lentivirus, ya que varios estudios muestran que corrigen la β-talasemia en modelos animales. Los objetivos de la terapia génica para esta enfermedad son: mejorar la transferencia de genes, introducir una gran cantidad de CMH modificadas y minimizar las consecuencias negativas de la integración aleatoria de los vehículos en el material genético.
Desafíos de la terapia génica
Un concepto importante relacionado con la seguridad de la terapia génica es la barrera de Weismann, que se refiere a que la información hereditaria solo pasa de las células germinales a las células somáticas, y no al revés.
La terapia génica en células germinales es mucho más debatida que en células somáticas. Pero incluso si la barrera de Weismann permitiera algún intercambio de información, como algunos expertos sugieren, la terapia en células somáticas también podría tener consideraciones éticas y de seguridad que antes no se habían tenido en cuenta. Estos aspectos se abordan en la Declaración Universal sobre el Genoma Humano.
La naturaleza de la terapia génica y sus vehículos a menudo implica que los pacientes deben repetir el tratamiento cada cierto tiempo porque no es permanente y su efecto es temporal.
El sistema inmune del cuerpo puede reaccionar ante un agente extraño como un virus o una secuencia de ADN externa. Además, esta respuesta se hace más fuerte con cada aplicación del mismo agente.
Problemas relacionados con los vehículos virales: Podrían contaminarse con sustancias químicas o con virus que causen enfermedades. También implican riesgos de respuesta del sistema inmunitario.
Trastornos multigénicos: Son un gran desafío para este tipo de terapia, ya que son enfermedades causadas por cambios en varios genes. Aplicar el tratamiento se vuelve mucho más difícil debido a la cantidad de genes a tratar.
Posibilidad de causar un tumor por mutagénesis: Esto puede ocurrir si el ADN se integra, por ejemplo, en un gen que normalmente suprime tumores. Esto ha sucedido en los estudios clínicos para SCID ligada al cromosoma X, donde 3 de 20 pacientes desarrollaron leucemia.
Terapia génica en otros animales
El primer ejemplo de terapia génica en mamíferos fue la corrección de la deficiencia en la producción de la hormona del crecimiento en ratones. Una mutación recesiva causaba que los ratones fueran enanos. Aunque tenían un gen de la hormona del crecimiento aparentemente normal, no producían el ARN necesario a partir de este gen.
El primer paso para corregir este problema fue inyectar miles de copias de un fragmento de ADN que contenía la parte del gen de la hormona del crecimiento de la rata, unido a una parte que activa el gen de la metalotioneína del ratón, en huevos de ratones enanos. La metalotioneína normalmente ayuda a eliminar metales pesados, por lo que su región reguladora responde a la presencia de metales pesados en el animal. Los huevos inyectados se implantaron en hembras. El 1% de los ratones nacidos fueron transgénicos y alcanzaron un tamaño mayor.
Se ha creado una tecnología similar para generar variedades transgénicas de salmón del Pacífico con un crecimiento rápido. Los resultados han sido impresionantes. Se inyectó en huevos de salmón un plásmido que llevaba el gen de la hormona del crecimiento regulado por el activador de la metalotioneína. Una pequeña parte de los peces resultantes fueron transgénicos, pesando once veces más que los no transgénicos.
Terapia génica en la cultura popular
En series de televisión como Dark Angel, la terapia génica se menciona como una de las prácticas realizadas en niños transgénicos y sus madres. También en la serie Alias, aparece la terapia génica molecular como explicación para dos individuos idénticos.
Es un elemento fundamental en la trama de videojuegos como Bioshock o Metal Gear Solid, y desempeña un papel importante en la trama de películas como Die Another Day, de James Bond o Soy leyenda de Will Smith, The Bourne Legacy, entre otras muchas.
Galería de imágenes
Véase también
 En inglés: Gene therapy Facts for Kids
En inglés: Gene therapy Facts for Kids
- Genética dirigida
- Estrella Rausell
- Javier de Felipe