Peryodato de potasio para niños
El peryodato de potasio es un compuesto químico que se forma con potasio y un grupo llamado peryodato. Su fórmula química es KIO4. Es una sal que se disuelve un poco en agua, formando una solución ligeramente alcalina (lo contrario de ácida).
Este compuesto es uno de los que menos se disuelve en agua entre las sales de potasio. Por esta razón, es útil para saber cuánto potasio hay en una muestra. Cuando se calienta, especialmente con un catalizador como el óxido de manganeso (IV), se descompone y forma yodato de potasio (KIO3), liberando oxígeno en forma de gas.
Datos para niños
Peryodato de potasio |
||
|---|---|---|
 |
||
| Nombre IUPAC | ||
| Peryodato de potasio | ||
| General | ||
| Otros nombres | metaperyodato de potasio | |
| Fórmula estructural | 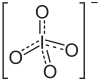 |
|
| Fórmula molecular | KIO4 | |
| Identificadores | ||
| Número CAS | 7790-21-8 | |
| ChemSpider | 128877 | |
| PubChem | 516896 | |
|
InChI
InChI=InChI=1S/HIO4.K/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1
Key: FJVZDOGVDJCCCR-UHFFFAOYSA-M |
||
| Propiedades físicas | ||
| Apariencia | Polvo blanco | |
| Densidad | 3618 kg/m³; 3,618 g/cm³ | |
| Masa molar | 230 g/mol | |
| Punto de fusión | 855 K (582 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 0.42 g/100 mL (20 °C) 4.4 g/100 mL (80 °C) |
|
| Peligrosidad | ||
| NFPA 704 |
0
2
2
OX
|
|
| Frases R | R8 R36/37/38 | |
| Frases S | S17 S26 S37 | |
| Riesgos | ||
| Ingestión | Puede ser nocivo. Enjuagar la boca con agua, atención médica. | |
| Inhalación | Irritación. Dar aire fresco, respiración artificial si es necesario, atención médica. | |
| Piel | Irritación. Lavar con jabón y abundante agua, atención médica. | |
| Ojos | Irritación. Enjuagar cuidadosamente con abundante agua por al menos 15 minutos, atención médica. | |
| Compuestos relacionados | ||
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
Contenido
¿Cómo se fabrica el peryodato de potasio?
El peryodato de potasio se puede crear en un laboratorio de varias maneras.
Oxidación con persulfato de potasio
Una forma es oxidar el yodato de potasio usando persulfato de potasio (K2S2O8). Esto se hace en una solución alcalina, como una de hidróxido de potasio.
La reacción ocurre mientras la solución está hirviendo. Después, se neutraliza la sal añadiendo ácido nítrico. Esto hace que el peryodato de potasio se separe de la solución, y luego se filtra.
Reacción con cloro
Otra manera es añadir cloro (Cl2) a una solución básica de yodato de potasio.
¿Qué propiedades tiene el peryodato de potasio?
El peryodato de potasio es un oxidante fuerte. Esto significa que puede quitar electrones a otras sustancias.
Por ejemplo, si una solución de yoduro de potasio entra en contacto con peryodato de potasio, el yoduro se convierte en diyodo. También puede transformar sales de manganeso (II) en permanganatos.
Estructura de los cristales
Los cristales de peryodato de potasio tienen una forma similar a los del perclorato de potasio (KClO4). Se dice que son isomorfos.
Recuperación del peryodato
Si el peryodato de potasio se disuelve en una solución de hidróxido de potasio, se puede recuperar añadiendo ácido nítrico.
Formación de ortoperyodato de potasio
Existe otro compuesto llamado ortoperyodato de potasio (K2H3IO6). Este se puede obtener oxidando el yodato de potasio con hipoclorito de sodio (NaClO). Cuando el ortoperyodato de potasio se calienta en agua a 100 °C, se descompone y forma peryodato de potasio como un paso intermedio.
Equilibrios en soluciones acuosas
En las soluciones de peryodato de potasio en agua, ocurren diferentes reacciones que están en equilibrio. Esto significa que las sustancias se transforman unas en otras constantemente.
Véase también
 En inglés: Potassium periodate Facts for Kids
En inglés: Potassium periodate Facts for Kids


