Nitrato de zinc para niños
Datos para niños
Nitrato de zinc |
||
|---|---|---|
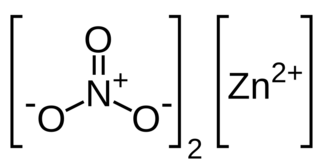 |
||
 |
||
| Nombre IUPAC | ||
| Nitrato de zinc | ||
| General | ||
| Fórmula estructural | 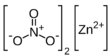 |
|
| Fórmula molecular | Zn(NO3)2 | |
| Identificadores | ||
| Número CAS | 7779-88-6 | |
| Número RTECS | ZH4772000 | |
| ChemSpider | 22926 | |
| PubChem | 24518 | |
| UNII | EDO66F5U49 | |
|
[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Zn+2]
|
||
|
InChI
InChI=S/2NO2.Zn/c2*2-1(3)4;/q2*-1;+2
Key: ONDPHDOFVYQSGI-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | sólido blanco, cristalino, altamente deliquescente | |
| Densidad | 2065 kg/m³; 2,065 g/cm³ | |
| Masa molar | 189,39 g/mol | |
| Punto de fusión | 383 K (110 °C) | |
| Punto de ebullición | 398 K (125 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 327 g/100 mL, 40 °C (trihidrato) 184.3 g/100 ml, 20 °C (hexahidrato) |
|
| Solubilidad | muy soluble en alcohol | |
| Riesgos | ||
| Riesgos principales | Oxidante, puede explotar al calentarlo | |
| Compuestos relacionados | ||
| Otros aniones | Sulfato de cinc Cloruro de cinc |
|
| Otros cationes | Nitrato de cadmio Nitrato de cobre (II) Nitrato de mercurio (II) |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El nitrato de zinc es un compuesto químico con la fórmula Zn(NO3)2. Es un material sólido de color blanco y tiene forma de cristales. Es muy higroscópico, lo que significa que absorbe la humedad del aire fácilmente. Por eso, a menudo se encuentra como un hidrato llamado hexahidrato, que tiene seis moléculas de agua unidas a cada molécula de nitrato de zinc (Zn(NO3)2•6H2O). Este compuesto se disuelve bien tanto en agua como en alcohol.
Contenido
¿Cómo se obtiene el nitrato de zinc?
El nitrato de zinc se puede crear en un laboratorio. Se forma al disolver el zinc en ácido nítrico. La forma en que se hace depende de la concentración del ácido.
Reacciones para producir nitrato de zinc
Cuando se usa ácido nítrico diluido (con mucha agua), la reacción es la siguiente:
- Zn + 2 HNO3 (diluido) → Zn(NO3)2 + H2
Si se usa ácido nítrico más concentrado, la reacción cambia un poco y también se forma otro compuesto:
- 4 Zn + 10 HNO3 (concentrado) → 4 Zn(NO3)2 + NH4NO3 + 3 H2O
¿Qué sucede al calentar el nitrato de zinc?
Si calientas el nitrato de zinc, se descompone en otras sustancias. Este proceso se llama termólisis. Al calentarse, forma óxido de cinc, dióxido de nitrógeno y oxígeno.
- 2 Zn(NO3)2 → 2 ZnO + 4 NO2 + O2
Usos y aplicaciones del nitrato de zinc
El nitrato de zinc no se utiliza en grandes cantidades en la industria, pero es muy útil en los laboratorios.
Aplicaciones en el laboratorio
- Se usa para crear polímeros de coordinación, que son materiales con estructuras especiales.
- Su descomposición controlada se utiliza para fabricar estructuras basadas en el óxido de zinc, como los nanocables, que son materiales muy pequeños con forma de hilo.
Uso en el teñido de telas
También puede usarse como mordiente en el proceso de teñido de telas. Un mordiente es una sustancia que ayuda a que el colorante se fije mejor a la tela.
Por ejemplo, el nitrato de zinc puede reaccionar con el carbonato de sodio para formar carbonato de zinc:
Véase también
 En inglés: Zinc nitrate Facts for Kids
En inglés: Zinc nitrate Facts for Kids

